
【题目】一定浓度的下列溶液,不外加任何试剂就能依次鉴别出来,正确的鉴别顺序为
① NaOH溶液 ② (NH4)2SO4溶液 ③ BaCl2溶液 ④ KNO3溶液 ⑤ FeCl3溶液
A.①②③④⑤ B.②③⑤④① C.⑤①②③④ D.⑤③②①④
 一线名师提优试卷系列答案
一线名师提优试卷系列答案 阳光试卷单元测试卷系列答案
阳光试卷单元测试卷系列答案科目:高中化学 来源: 题型:
【题目】下图是另一种元素周期表——三角形元素周期表的一部分,图中标示了L、M、Q、R、T元素的位置,下列判断正确的是
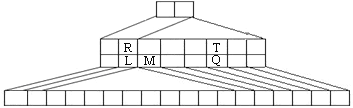
A.Q、T两元素的氢化物的稳定性为HnT<HnQ
B.L、R的单质与盐酸反应速率为R>L
C.M与T形成的化合物有两性
D.L、Q形成的简单离子核外电子数相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于现行的元素周期表的说法正确的是( )
A.元素周期表有8个副族
B.元素周期表有7个周期
C.短周期是指第一、二周期
D.IA族的元素全部是金属元素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】今有一混合溶液,只可能含有以下离子中的若干种:Na+、NH4+、Cl-、Ba2+、CO32-、SO42-、OH-,现取三份各100 mL的溶液进行如下实验(每步实验均仅进行完全),根据实验内容填写相应结论:
(1)第一份加足量NaOH溶液加热后,收集到0.68gNH3气体,原溶液中一定不含有________;
(2)第二份加足量BaCl2溶液后,得干燥沉淀6.27 g,经足量盐酸洗涤、干燥后,沉淀质量为2.33 g。
综合以上实验,原溶液中一定含有________、________,一定不含有________;
(3)第三份加入AgNO3溶液有沉淀产生。
原溶液中还一定存在______,可能存在_______(若没有,两空均可不填)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA表示阿伏加德罗常数,下列叙述正确的是 ( )
A. 1mo1 Na2O2固体中含离子总数为4NA
B. 17gNH3所含的电子数为10NA
C. 1molL1 NaCl溶液中含有Na+的个数为NA
D. 标准状况下,22.4 L的SO3中含有NA个SO3分子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】500 mL KNO3和Cu(NO3)2的混合溶液中c(NO![]() )=0.6 mol·L-1,用石墨作电极电解此溶液,当通电一段时间后,两极均收集到2.24 L气体(标准状况下),假定电解后溶液体积仍为500 mL,下列说法正确的是
)=0.6 mol·L-1,用石墨作电极电解此溶液,当通电一段时间后,两极均收集到2.24 L气体(标准状况下),假定电解后溶液体积仍为500 mL,下列说法正确的是
A.原混合溶液中c(K+)为0.2 mol·L-1
B.上述电解过程中共转移0.2 mol电子
C.电解得到的Cu的物质的量为0.05 mol
D.电解后溶液中c(H+)为0.2 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)为清理路面积雪人们常使用一种融雪剂,其主要成分的化学式为XY2,X、Y均为周期表前20号元素,其阳离子和阴离子的电子层结构相同,且1 mol XY2含有54 mol电子。该融雪剂的化学式是____________,该物质中化学键类型是___________,电子式是_________。
(2)已知A、B、C、D是中学化学中常见的四种不同粒子.它们之间存在如图所示的转化关系.
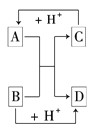
如果A、B、C、D均是10电子的粒子,请写出:A的结构式________,D的电子式________.
(3)下列说法正确的是 (填写字母序号) ____________
A.晶体中分子间作用力越大,分子越稳定
B. 分子晶体的熔沸点比较低
C.冰融化时水分子中共价键发生断裂
D.氯化钠熔化时离子键未破坏
E.在离子化合物里,只存在离子键,没有共价键
F.任何分子中一定都存在化学键
G.在共价化合物分子内,一定不存在离子键
H.全部由非金属元素形成的化合物中不可能含有离子键
(4)下列各组物质的晶体中,化学键类型相同、晶体类型也相同的是 ______
A.NaOH和NaCl B.CO2和H2
C.NaCl和HCl D.CCl4和KCl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于电化学的实验事实正确的是( )
出现环境 | 实验事实 | |
A | 以稀H2SO4为电解质的Cu-Zn原电池 | Cu为正极,正极上发生还原反应 |
B | 电解CuCl2溶液 | 电子经过负极→阴极 |
C | 弱酸性环境下钢铁腐蚀 | 负极处产生H2,正极处吸收O2 |
D | 将钢闸门与外加电源负极相连 | 牺牲阳极阴极保护法,可防止钢闸门腐蚀 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com