
分析 (1)正常雨水中溶解CO2,pH约为5.6;
(2)二氧化硫具有还原性,能够被氯水中的氯气氧化,生成盐酸、硫酸两种强酸;
(3)依据反应中硫元素化合价变化解答;
(4)检验氯离子的存在,通常用银离子反应生成白色沉淀氯化银,注意排除硫酸根离子、亚硫酸根离子的干扰.
解答 解:(1)正常雨水的pH约为5.6;
故答案为:5.6;
(2)二氧化硫具有还原性,能够被氯水中的氯气氧化,反应的化学方程式:SO2+Cl2+2H2O=H2SO4+2HCl,反应生成盐酸和硫酸都是强酸,溶液酸性增强,pH变小;
故答案为:SO2+Cl2+2H2O=H2SO4+2HCl;变小;
(3)在反应SO2+Cl2+2H2O=H2SO4+2HCl,二氧化硫中的硫,化合价升高,发生氧化反应,本身做还原剂,表现还原性;
故选:C;
(4)检验氯离子的存在,通常用银离子反应生成白色沉淀氯化银,注意排除硫酸根离子、亚硫酸根离子的干扰,所以正确的操作为:滴加过量Ba(NO3)2 溶液,过滤后向滤液滴加AgNO3溶液,有白色沉淀生成,证明有Cl-;
故答案为:滴加过量Ba(NO3)2 溶液,过滤后向滤液滴加AgNO3溶液,有白色沉淀生成,证明有Cl-.
点评 本题考查了物质的性质及离子的检验,熟悉二氧化硫的性质是解题关键,题目难度不大.


 暑假作业暑假快乐练西安出版社系列答案
暑假作业暑假快乐练西安出版社系列答案科目:高中化学 来源: 题型:解答题
| 周期 族 | IA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ① | ② | ||||||
| 3 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | |
| 4 | ⑩ | ⑪ | ⑫ |
 ;⑪
;⑪ .
. ;在一定条件下,若将元素①的单质和氢气的混合气体通入4L的密闭容器中发生反应,半分钟后测得生成物的物质的量为1.4mol,则用元素①的单质表示的反应速率为0.35mol/(L•min).
;在一定条件下,若将元素①的单质和氢气的混合气体通入4L的密闭容器中发生反应,半分钟后测得生成物的物质的量为1.4mol,则用元素①的单质表示的反应速率为0.35mol/(L•min).查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | Br2在反应中表现氧化性 | B. | SO2在反应中被还原 | ||
| C. | Br2在反应中得电子 | D. | 1mol氧化剂在反应中得到1mol电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 25℃ | B. | 1.01×103Pa | C. | 101kPa | D. | 0℃ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 实验室制备硝基苯的反应原理和实验装置如下:
实验室制备硝基苯的反应原理和实验装置如下: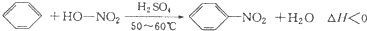
| 物质 | 熔点/℃ | 沸点/℃ | 密度/g•cm-3 | 溶解性 |
| 苯 | 5.5 | 80 | 0.88 | 微溶于水 |
| 硝基苯 | 5.7 | 210.9 | 1.205 | 难溶于水 |
| 间二硝基苯 | 89 | 301 | 1.57 | 微溶于水 |
| 浓硝酸 | 83 | 1.4 | 易溶于水 | |
| 浓硫酸 | 338 | 1.84 | 易溶于水 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
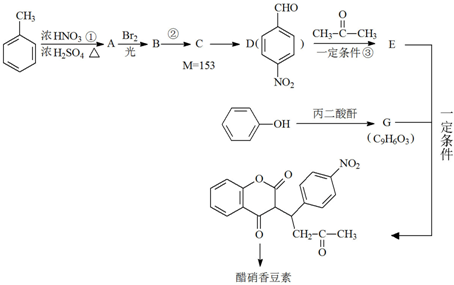
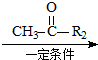 R1-CH=
R1-CH=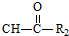 +H2O
+H2O 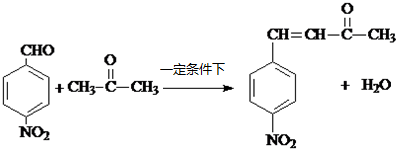
 .
.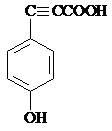 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com