
【题目】某同学用NaOH配制0.10molL-1的500mLNaOH溶液的过程如图所示:你认为该同学的错误步骤有( )
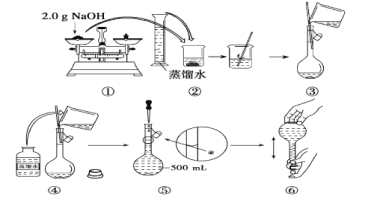
A. 1处B. 2处C. 3处D. 4处
科目:高中化学 来源: 题型:
【题目】元素在周期表中的位置,反映了元素的原子结构和元素的性质,下图是元素周期表的一部分。
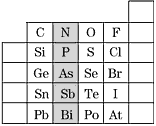
(1)上图中元素N在元素周期表中的位置为_________________,根据元素周期律,请预测H3AsO4、H3PO4的酸性强弱:H3AsO4________H3PO4(填“强于”或“弱于”)。
(2)上图中元素O、S、Se的氢化物的沸点由高到低为:________>________>________。(用化学式填写)_____________
(3)写出S2-的离子结构示意图为______________;判断表中Bi和Te两种元素的金属性强弱:Bi________Te(填“<”或“>”或“=”)。
(4)Br2具有较强的氧化性,SO2具有较强的还原性,请写出将SO2气体通入溴水中反应的离子方程式:________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在含有35.8g Na2CO3和NaHCO3混合物的溶液中加入200mL 某浓度的盐酸,恰好完全反应,生成8.96L CO2(标准状况)。问:
(1)原溶液中有__________mol Na2CO3,__________mol NaHCO3。
(2)盐酸的物质的量浓度_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下的定容容器中,发生反应:2A(g)+B(s)![]() C(g)+D(g),下列描述中能表明反应已达到平衡状态的是( )
C(g)+D(g),下列描述中能表明反应已达到平衡状态的是( )
①单位时间内生成n molC,同时生成n mol D
②单位时间内生成n molD,同时生成2n mol A
③C(g)的物质的量浓度不变
④容器内A、C、D三种气体的浓度之比为2:1:1
⑤v(A):v(C):v(D)=2:1:1
A. ②③ B. ②③④ C. ②⑤ D. ②③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钛是一种重要的金属,以钛铁矿[主要成分为钛酸亚铁(FeTiO3),还含有少量Fe2O3]为原料制备钛的工艺流程如图所示。

(1)滤液1中钛元素以TiO2+形式存在,则“溶浸”过程发生的主要反应的化学方程式为________。
(2)物质A为________(填化学式),“一系列操作”为________。
(3)“水解”步骤中生成TiO2·xH2O,为提高TiO2·xH2O的产率,可采取的措施有________、________。(写出两条)。
(4)“电解”是以石墨为阳极,TiO2为阴极,熔融CaO为电解质。阴极的电极反应式为________;若制得金属Ti 9.60g,阳极产生气体________mL(标准状况下)。
(5)将少量FeSO4·7H2O溶于水,加入一定量的NaHCO3溶液,可制得FeCO3,写出反应的离子方程式________;若反应后的溶液中c(Fe2+)=2×10-6mol·L-1,则溶液中c(CO32-)=________mol·L-1。(已知:常温下FeCO3饱和溶液浓度为4.5×10-6mol·L-1)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将w1(g)光亮的铜丝在空气中加热一段时间后,迅速插入下列物质中,取出干燥,如此反复几次,最后取出铜丝,用蒸馏水洗涤,干燥,称其质量为w2(g),实验时由于所插入的物质不同,铜丝的前后质量变化可能不同,下列所插物质与铜丝的质量关系不正确的是
A. CO w1= w2 B. 石灰水 wl< w2
C. 乙醇溶液 w1<w2 D. NaHSO4溶液 w1>w2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物W用作调香剂、高分子材料合成的中间体等,制备W的一种合成路线如下。

请回答下列问题:
(1)F的化学名称是________,⑤的反应类型是________。
(2)E中含有的官能团是________(写名称),D聚合生成高分子化合物的结构简式为________。
(3)将反应③得到的产物与O2在催化剂、加热的条件下反应可得D,写出反应④的化学方程式________。
(4)④、⑤两步能否颠倒?________(填“能”或“否”)理由是________。
(5)与A具有含有相同官能团的芳香化合物的同分异构体还有________种(不含立体异构),其中核磁共振氢谱为六组峰,且峰面积之比为1:1:2:2:2:2的结构简式为________。
(6)参照有机物W的上述合成路线,以M和CH3Cl为原料制备F的合成路线(无机试剂任选)________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制备苯甲醇和苯甲酸的化学原理是

已知苯甲醛易被空气氧化,苯甲醇的沸点为205.3 ℃,苯甲酸的熔点为121.7 ℃,沸点为249 ℃,溶解度为0.34 g;乙醚的沸点为34.8 ℃,难溶于水。制备苯甲醇和苯甲酸的主要过程如下所示:

试根据上述信息,判断以下说法错误的是( )
A. 操作Ⅰ是萃取分液
B. 乙醚溶液中所溶解的主要成分是苯甲醇
C. 操作Ⅱ蒸馏所得产品甲是苯甲醇
D. 操作Ⅲ过滤得到产品乙是苯甲酸钾
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电子工业常用30%的FeCl3溶液腐蚀敷在绝缘板上的铜箔,制造印刷电路板。
(1)检验溶液中Fe3+存在的试剂是________,证明Fe3+存在的现象是________。
(2)写出FeCl3溶液与金属铜发生反应的离子方程式:________。
(3)某工程师为了从使用过的腐蚀废液中回收铜,并重新获得纯净的FeCl3溶液,准备采用下列步骤:

请写出上述实验中加入或生成的有关物质的化学式。
①________,④________。
(4)要证明某溶液中不含Fe3+而可能含有Fe2+,进行如下实验操作时的最佳顺序为________。
①加入足量氯水②加入足量KMnO4溶液③加入少量KSCN溶液
A.①③ B.③② C.③① D.①②③
(5)写出向②⑤的混合液中通入⑥的离子方程式:________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com