
用含杂质(杂质不与酸作用,也不溶于水)的铁10克与50克稀硫酸完全反应后,滤去杂质,所得液体质量为55.4克,求此铁的纯度。
科目:高中化学 来源: 题型:阅读理解
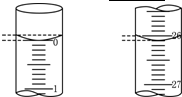 某学生用已知物质的量浓度的盐酸来滴定未知物质的量浓度的氢氧化钠溶液时,选择酚酞作指示剂.请填写下列空白:
某学生用已知物质的量浓度的盐酸来滴定未知物质的量浓度的氢氧化钠溶液时,选择酚酞作指示剂.请填写下列空白:| 滴定 次数 |
待测氢氧化钠溶液的体积/mL | 0.1000 mol/L盐酸的体积(mL) | |
| 滴定前刻度 | 定后刻度 | ||
| 第一次 | 25.00 | 0.00 | 26.11 |
| 第二次 | 25.00 | 1.56 | 30.30 |
| 第三次 | 25.00 | 0.22 | 26.31 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
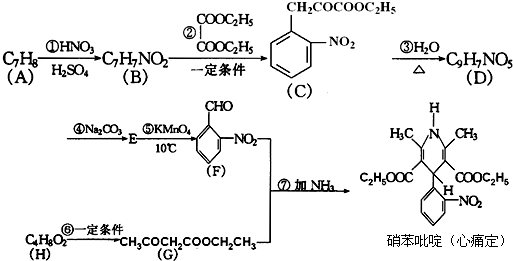
 +H2O
+H2O
| ||
| △ |
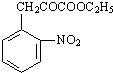
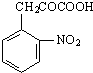 +C2H5OH
+C2H5OH +H2O
+H2O
| ||
| △ |
 +C2H5OH
+C2H5OH| 一定条件下 |
| 一定条件下 |
| ||
| 1000G |
| W总 |
| 10 |
| ||
| 1000G |
| W总 |
| 10 |
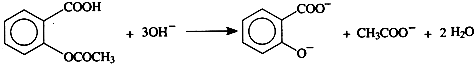
查看答案和解析>>
科目:高中化学 来源:2010年江西省高三10月月考化学试题 题型:选择题
现有一工业纯碱样品(含少量氯化钠等不与酸反应的杂质),用如图装置测定样品中碳酸钠的质量分数,其中正确的是


查看答案和解析>>
科目:高中化学 来源:辽宁省期末题 题型:实验题


查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com