
【题目】二甲醚又称甲醚,简称 DME,熔点![]() ,沸点
,沸点![]() ,与石油液化气(LPG)相似,被誉为“21世纪的清洁燃料”。 由合成气(
,与石油液化气(LPG)相似,被誉为“21世纪的清洁燃料”。 由合成气(![]() )制备二甲醚的反应原理如下:
)制备二甲醚的反应原理如下:
①![]()
②![]()
回答下列问题:
(1)已知:![]() ,若由合成气(
,若由合成气(![]() ) 制备
) 制备 ![]() ,且生成
,且生成![]() ,其热化学方程式为_______________。
,其热化学方程式为_______________。
(2)有人模拟该制备原理:500K时,在2L的密闭容器中充入![]() 和
和![]() . 5min达到平衡,平衡时测得
. 5min达到平衡,平衡时测得![]() ,
,![]() ,此时
,此时![]() 的转化率为___________。用
的转化率为___________。用 ![]() 表示反应①的速率是_____________
表示反应①的速率是_____________![]() ,可逆反应②的平衡常数
,可逆反应②的平衡常数 ![]() =_______________________
=_______________________
(3)在体积一定的密闭容器中发生反应②,如果该反应的平衡常数![]() 值变小,则下列说法正确的是_________________ 。
值变小,则下列说法正确的是_________________ 。

A. 平衡向正反应方向移动
B. 平衡移动的原因是升高了温度
C. 达到新平衡后体系的压强不变
D. 容器中![]() 的体积分数减小
的体积分数减小
(4)一定条件下在恒温恒容的密闭容器中,按不同投料比充入![]() 和
和![]() 进行反应①,平衡时
进行反应①,平衡时![]() 和
和![]() 的转化率如图所示,则a=________ (填数值)。
的转化率如图所示,则a=________ (填数值)。
(5)用活性炭还原法处理氮氧化物的有关反应为:![]() 。向恒容密闭容器中加入一定量的活性炭和
。向恒容密闭容器中加入一定量的活性炭和![]() ,恒温(
,恒温(![]() )时,各物质的浓度随时间的变化如下表:
)时,各物质的浓度随时间的变化如下表:
浓度/ 时间/min |
|
|
|
0 | 0.100 | 0 | 0 |
10 | 0.058 | 0.021 | 0.021 |
20 | 0.040 | 0.030 | 0.030 |
30 | 0.040 | 0.030 | 0.030 |
40 | 0.032 | 0.034 | 0.017 |
50 | 0.032 | 0.034 | 0.017 |
在31 min时,若只改变某一条件使平衡发生移动,40 min,50 min时各物质的浓度如上表所示,则改变的条件是__________________。
在51 min时,保持温度和容器体积不变再充入![]() 和
和![]() ,使二者的浓度均增加至原来的两倍,此时化学平衡__(填“正向移动”、“逆向移动”或“不移动”)。
,使二者的浓度均增加至原来的两倍,此时化学平衡__(填“正向移动”、“逆向移动”或“不移动”)。
【答案】![]()
![]() 0.12 1 BD 2 减小
0.12 1 BD 2 减小![]() 的浓度 正向移动
的浓度 正向移动
【解析】
(1)①CO(g)+2H2(g)![]() CH3OH(g)△H1=-90.0kJmo l -1,②2CH3OH(g)
CH3OH(g)△H1=-90.0kJmo l -1,②2CH3OH(g)![]() CH3OCH3(g)+H2O(g)△H2=-20.0kJmo l-1,③H2O(1)=H2O(g)△H=+44.0kJ/mol,CO、H2制备1molCH3OCH3和H2O的化学方程式为2CO(g)+4H2(g)
CH3OCH3(g)+H2O(g)△H2=-20.0kJmo l-1,③H2O(1)=H2O(g)△H=+44.0kJ/mol,CO、H2制备1molCH3OCH3和H2O的化学方程式为2CO(g)+4H2(g)![]() CH3OCH3(g)+H2O(l ),根据盖斯定律2×①+②-③得到反应的热化学方程式;
CH3OCH3(g)+H2O(l ),根据盖斯定律2×①+②-③得到反应的热化学方程式;
(2)平衡体系中c(CH3OCH3)=c(H2O)=0.2mo lL-1,根据H原子守恒计算c(CH3OH),再根据C守恒计算c(CO),最后利用平衡的三段式计算反应②的平衡常数K2;
(3)在体积一定的密闭容器中发生反应②2CH3OH(g)![]() CH3OCH3(g)+H2O(g)△H2=-20.0kJ/mol,反应的平衡常数K2值变小,说明平衡逆向进行,改变的是温度,升温平衡逆向进行;
CH3OCH3(g)+H2O(g)△H2=-20.0kJ/mol,反应的平衡常数K2值变小,说明平衡逆向进行,改变的是温度,升温平衡逆向进行;
(4)一定条件下在恒温恒容的密闭容器中,按不同投料比充入CO(g)和H2(g)进行反应①,平衡时CO(g)和H2(g)的转化率如图1,a点是一氧化碳和氢气转化率相同;
(5)依据图表数据变化分析,30min末一氧化氮和二氧化碳浓度减小,氮气浓度增大,结合计算平衡常数和浓度变化分析判断;在51min时,保持温度和容器体积不变再充入NO和N2,使二者的浓度均增加至原来的两倍,计算此时的浓度商和平衡常数比较判断反应进行的方向。
(1)①CO(g)+2H2(g)![]() CH3OH(g)△H1=-90.0kJmol-1,②2CH3OH(g)
CH3OH(g)△H1=-90.0kJmol-1,②2CH3OH(g)![]() CH3OCH3(g)+H2O(g)△H2=-20.0kJmol-1,③H2O(1)=H2O(g)△H=+44.0kJ/mol,CO、H2制备1molCH3OCH3和H2O的化学方程式为2CO(g)+4H2(g)
CH3OCH3(g)+H2O(g)△H2=-20.0kJmol-1,③H2O(1)=H2O(g)△H=+44.0kJ/mol,CO、H2制备1molCH3OCH3和H2O的化学方程式为2CO(g)+4H2(g)![]() CH3OCH3(g)+H2O(l),根据盖斯定律2×①+②-③得到2CO(g)+4H2(g)
CH3OCH3(g)+H2O(l),根据盖斯定律2×①+②-③得到2CO(g)+4H2(g)![]() CH3OCH3(g)+H2O(l)的)△H=2×(-90.0kJmol-1)+(-20.0kJmol-1)-(+44.0kJ/mol)═-244.0kJmol-1,所以热化学方程式为2CO(g)+4H2(g)
CH3OCH3(g)+H2O(l)的)△H=2×(-90.0kJmol-1)+(-20.0kJmol-1)-(+44.0kJ/mol)═-244.0kJmol-1,所以热化学方程式为2CO(g)+4H2(g)![]() CH3OCH3(g)+H2O(l)△H=-244.0kJmol-1;
CH3OCH3(g)+H2O(l)△H=-244.0kJmol-1;
(2)由反应②2CH3OH(g)![]() CH3OCH3(g)+H2O(g)可知:平衡体系中c(CH3OCH3)=c(H2O)=0.2molL-1,由H原子守恒有1.8mol/L+2×c(H2O)+6×c(CH3OCH3)+4×c(CH3OH)=2×3,所以c(CH3OH)=0.2mol/L,根据C原子守恒剩余有c(CO)=1-c(CH3OH)-2c(CH3OCH3)=0.4mol/L,CO的转化率=
CH3OCH3(g)+H2O(g)可知:平衡体系中c(CH3OCH3)=c(H2O)=0.2molL-1,由H原子守恒有1.8mol/L+2×c(H2O)+6×c(CH3OCH3)+4×c(CH3OH)=2×3,所以c(CH3OH)=0.2mol/L,根据C原子守恒剩余有c(CO)=1-c(CH3OH)-2c(CH3OCH3)=0.4mol/L,CO的转化率=![]() ×100%=60%,反应①中CH3OH的变化浓度等于CO的变化浓度,即为1mol/L-0.4mol/L=0.6mol/L,则用
×100%=60%,反应①中CH3OH的变化浓度等于CO的变化浓度,即为1mol/L-0.4mol/L=0.6mol/L,则用 ![]() 表示反应①的速率是
表示反应①的速率是![]() =0.12
=0.12![]() ;平衡时反应②2CH3OH(g)
;平衡时反应②2CH3OH(g)![]() CH3OCH3(g)+H2O(g)的平衡浓度分别为c(CH3OH)=0.2mol/L,c(CH3OCH3)=c(H2O)=0.2molL-1,反应②的平衡常数K2=
CH3OCH3(g)+H2O(g)的平衡浓度分别为c(CH3OH)=0.2mol/L,c(CH3OCH3)=c(H2O)=0.2molL-1,反应②的平衡常数K2=![]() =1;
=1;
(3)在体积一定的密闭容器中发生反应②2CH3OH(g)![]() CH3OCH3(g)+H2O(g)△H2=-20.0kJ/mol,如果该反应的平衡常数K2值变小,说明平衡逆向进行,改变的是温度,升温平衡逆向进行;
CH3OCH3(g)+H2O(g)△H2=-20.0kJ/mol,如果该反应的平衡常数K2值变小,说明平衡逆向进行,改变的是温度,升温平衡逆向进行;
A.升温平衡逆向进行,故A 错误;
B.平衡常数只与温度有关,平衡常数K2值变小,则平衡逆向进行,所以改变条件为升温,故B正确;
C.气体物质的量虽然不变,但升温容器中混合气体的压强增大,故C错误;
D.温度升高,平衡逆向移动,容器中CH3OCH3的体积分数降低,故D正确;
故答案为:BD;
(4)一定条件下在恒温恒容的密闭容器中,按不同投料比充入CO(g)和H2(g)进行反应①,CO(g)+2H2(g)![]() CH3OH(g)△H1=-90.0kJmol-1,平衡时CO(g)和H2(g)的转化率如图1所示,a点是一氧化碳和氢气转化率相同,则一氧化碳和氢气起始量等于1:2,则n(H2):n(CO)=2:1,a=2;
CH3OH(g)△H1=-90.0kJmol-1,平衡时CO(g)和H2(g)的转化率如图1所示,a点是一氧化碳和氢气转化率相同,则一氧化碳和氢气起始量等于1:2,则n(H2):n(CO)=2:1,a=2;
(5)30min时改变某一条件,反应重新达到平衡时c(N2)=0.34mol/L;c(CO2)=0.17mol/L;c(NO)=0.32mol/L;则平衡常数K= ![]() =
= ![]() =0.56,平衡常数不变说明改变的条件一定不是温度;依据数据分析,氮气浓度增大,二氧化碳和一氧化氮浓度减小,反应前后气体体积不变,所以减小二氧化碳浓度,平衡正向进行的结果;在51min时,保持温度和容器体积不变再充入NO和N2,使二者的浓度均增加至原来的两倍,Qc=
=0.56,平衡常数不变说明改变的条件一定不是温度;依据数据分析,氮气浓度增大,二氧化碳和一氧化氮浓度减小,反应前后气体体积不变,所以减小二氧化碳浓度,平衡正向进行的结果;在51min时,保持温度和容器体积不变再充入NO和N2,使二者的浓度均增加至原来的两倍,Qc=![]() =0.28<K=0.56,化学平衡正向移动。
=0.28<K=0.56,化学平衡正向移动。


 字词句段篇系列答案
字词句段篇系列答案科目:高中化学 来源: 题型:
【题目】已知![]() 和NaCl混合溶液中,
和NaCl混合溶液中,![]() 的物质的量浓度是
的物质的量浓度是![]() 的物质的量浓度的
的物质的量浓度的![]() 倍,下列叙述中正确的是
倍,下列叙述中正确的是![]()
A.溶液中一定有![]() 和3molNaCl
和3molNaCl
B.所带电荷数![]() 是
是![]() 的
的![]() 倍
倍
C.![]() 与
与![]() 的物质的量之和等于
的物质的量之和等于![]() 的物质的量
的物质的量
D.![]() 和NaCl的物质的量之比为1:3
和NaCl的物质的量之比为1:3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,反应![]() ,在密闭容器中达到平衡状态,下列说法正确的是( )
,在密闭容器中达到平衡状态,下列说法正确的是( )
A.体积不变,加少许![]() 化学平衡正向移动,再达到平衡状态时与原平衡相比颜色变深
化学平衡正向移动,再达到平衡状态时与原平衡相比颜色变深
B.加压时(体积变小),将使正反应速率增大,逆反应速率减慢
C.体积不变,加少许![]() ,化学平衡逆向移动,再达到平衡状态时与原平衡相比颜色变浅
,化学平衡逆向移动,再达到平衡状态时与原平衡相比颜色变浅
D.保持体积不变,升高温度,化学平衡正向移动,再达到平衡状态时混合气体密度变小
查看答案和解析>>
科目:高中化学 来源: 题型:
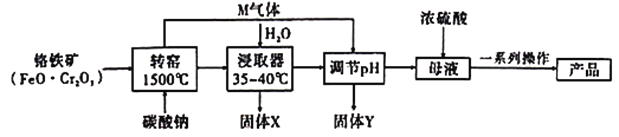
【题目】重铬酸钾(![]() )在制革工业、印刷工业、电镀工业等有重要用途用工业上以铬铁矿
)在制革工业、印刷工业、电镀工业等有重要用途用工业上以铬铁矿![]() ,含
,含![]() 杂质)为原料制备重铬酸钾的工艺如下:
杂质)为原料制备重铬酸钾的工艺如下:
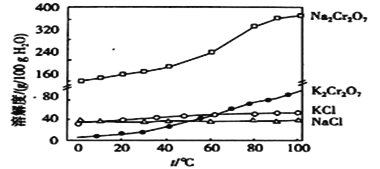
已知:①![]() ;②有关物质的溶解度曲线如图:
;②有关物质的溶解度曲线如图:
(1)转窑中发生的主要反应除了下面的两个反应外,还有其他反应。
①![]() ;
;
②___![]() ___
___![]() +____
+____![]() ___
___![]() ___
___![]() ___________。
___________。
请配平反应②的化学方程式。
③请写出其他主要反应的化学方程式:_________________________________。
(2)灼烧是中学化学中常用的操作方法,如在实验室中将铬铁矿和碳酸钠固体混合物灼烧,下列各实验仪器中不需要的是___________(填序号)。
A.陶瓷坩埚 B.铁坩埚 C.三脚架 D.泥三角
(3)固体Y成分的化学式为_________________。
(4)向母液中加入浓硫酸,把铬酸钠转化为重铬酸钠,试从平衡的角度说明_______________________________________________________________________。
(5)在“一系列操作”中,其中有一步是加入![]() ,获得该产品的原理是____________________________。
,获得该产品的原理是____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在1L的密闭容器中充入2mol N2和7mol H2,发生反应N2+3H2=2NH3,保持其他条件不变,相同时间内测得NH3的浓度与温度的关系如图所示.下列叙述不正确的是
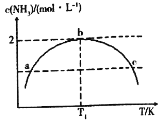
A.该反应是放热反应
B.a、c两点对应的压强 Pa<Pc
C.温度为T1时,N2的平衡转化率为50%
D.温度为T1时,再加入1mol N2和1mol NH3,平衡向正反应方向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】食用花生油中含有油酸,油酸是一种不饱和脂肪酸,对人体健康有益,其分子结构如图所示:下列说法不正确的是( )
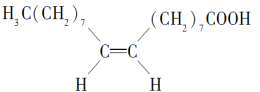
A.油酸的分子式为C18H34O2
B.油酸可与氢氧化钠溶液发生中和反应
C.1 mol油酸可与2 mol H2发生加成反应
D.1 mol甘油可与3 mol油酸发生酯化反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关如图所示的说法正确的是

A. 图甲中开关置于N处时铜锌合金腐蚀的速率增大
B. 图乙中接通开关时,锌腐蚀的速率增大,锌上放出气体的速率增大
C. 图丙中接通K2时铁棒不被腐蚀,属于牺牲阳极保护法
D. 图丙中接通K1时,石墨棒周围溶液的pH增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请解答下列与蛋白质有关的题目:
(1)鸡蛋腐烂时,常闻到有臭鸡蛋气味的气体,该气体中主要含有___________________(填化学式),说明蛋白质中含有___________________(填元素名称)元素。
(2)误食重金属盐会中毒,这是因为___________________。
(3)浓硝酸溅在皮肤上,使皮肤呈现___________________色,这是由于浓硝酸和蛋白质发生了___________________反应。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于离子方程式或离子共存的说法中正确的是![]()
A.向 ![]() 溶液中加入稀
溶液中加入稀 ![]() :
:![]()
B.![]() 溶液中加入足量
溶液中加入足量 ![]() 溶液:
溶液:![]()
C.某溶液中只存在以下 4种离子:![]() 、
、![]() 、
、![]() 、R离子
、R离子![]() 忽略微量的
忽略微量的 ![]() ,且浓度均为
,且浓度均为 ![]() ,则 R离子可能为
,则 R离子可能为 ![]()
D.![]() 的溶液中:
的溶液中:![]() 、
、![]() 、
、![]() 、
、![]() 能大量共存。
能大量共存。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com