
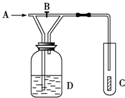
 如图,从A处通入纯净的Cl2,打开B阀时,C处的红色布条上看不到明显现象;当关闭B阀后,C处红布逐渐褪色,则D瓶中装的是( )
如图,从A处通入纯净的Cl2,打开B阀时,C处的红色布条上看不到明显现象;当关闭B阀后,C处红布逐渐褪色,则D瓶中装的是( )| A. | 浓H2SO4 | B. | NaOH溶液 | C. | H2O | D. | 饱和NaCl溶液 |
分析 干燥氯气不具有漂白性,次氯酸具有漂白性,打开B阀时,C处的红色布条上看不到明显现象;当关闭B阀后,C处红布逐渐褪色,说明A通入的是干燥的氯气,D中物质不能与氯气反应,且能够提供分,据此解答.
解答 解:A.浓硫酸具有吸水性,不能提供水分子,故A不选;
B.氢氧化钠溶液能够与氯气反应,故B不选;
C.氯气通入水,携带出水蒸汽,氯气与水反应生成次氯酸具有漂白性,符合题意,故C选;
D.饱和食盐水中含有水,且与水不反应,氯气与水反应生成次氯酸具有漂白性,符合题意,故D选;
故选:CD.
点评 本题考查氯气的化学性质,明确装置中D瓶的作用是解答本题的关键,注意干燥的氯气不具有漂白性,题目难度不大.


 全能练考卷系列答案
全能练考卷系列答案 一课一练课时达标系列答案
一课一练课时达标系列答案科目:高中化学 来源: 题型:选择题
| A. | 用铁作阴极 | B. | 用碳棒作正极 | ||
| C. | 食盐水从阳极区加入 | D. | 烧碱溶液从阴极区流出 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
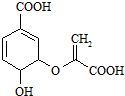
| A. | 分子式为C10H8O6 | |
| B. | 分子中含有2种官能团 | |
| C. | 可与乙醇、乙酸反应,且反应类型相同 | |
| D. | 1mol分枝酸最多可与3mol NaOH发生中和反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅤⅡA | 0 |
| 2 | C | N | O | |||||
| 3 | Na | Mg | Si | S | Cl | Ar | ||
| 4 | Ca |
 ;Ca的最外层电子数为2.
;Ca的最外层电子数为2.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
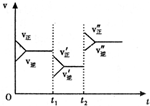
| A. | t1时若是降温使速率变化,则正确反应是放热反应 | |
| B. | t2时若是加压使速度变化,则A、B、C、D均为气体 | |
| C. | t2时改变的条件可能是加入催化剂 | |
| D. | t2时改变的条件可能是增大反应物的浓度 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 浓度为0.1 mol•L-1的碳酸钠溶液:c(Na+)=2c(CO32-)+c(HCO3-)+c(H2CO3) | |
| B. | pH=12的氨水溶液与pH=2的盐酸等体积混合:c(Cl-)>c(NH4+)>c(H+)>c(OH-) | |
| C. | 等物质的量的氨水和盐酸混合后的溶液:c(H+)=c(OH-)+c(NH3•H2O) | |
| D. | 醋酸溶液与NaOH溶液相混合后,所得溶液呈中性:c(Na+)>c(CH3COO-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2Fe3++SO32-+H2O→2Fe2++SO42-+2H+ | |
| B. | I2+SO32-+H2O→SO42-+2I-+2H+ | |
| C. | 2Fe2++I2→2Fe3++2I- | |
| D. | Br2+SO32-+H2O→SO42-+2Br-+2H+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com