
【题目】NOx(主要指NO和NO2)是大气主要污染物之一。有效去除大气中的NOx是环境保护的重要课题。
在有氧条件下,新型催化剂M能催化NH3与NOx反应生成N2。
将一定比例的O2、NH3和NOx的混合气体,匀速通入装有催化剂M的反应器中反应。
反应相同时间NOx的去除率随反应温度的变化曲线如图所示,在50~250℃范围内随着温度的升高,NOx的去除率先迅速上升后上升缓慢的主要原因是___;当反应温度高于380℃时,NOx的去除率迅速下降的原因可能是__。
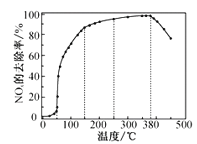
【答案】迅速上升段是催化剂活性随温度升高增大与温度升高共同使NOx去除反应速率迅速增大;上升缓慢段主要是温度升高引起的NOx去除反应速率增大,催化剂活性下降 NH3与O2反应生成了NO
【解析】
因为反应相同时间,所以低温时主要考虑温度和催化剂对化学反应速率的影响,高温时,NH3与O2发生催化氧化反应。在![]() 范围内,NOx的去除率迅速上升是催化剂活性随温度升高增大与温度升高共同使NOx去除反应速率迅速增大;上升缓慢阶段主要是温度升高引起NOx去除反应速率增大,但温度升高催化剂活性下降,反应温度高于380℃时,NOx的去除率迅速下降是因为可能NH3与O2反应生成了NO,其化学反应方程式为:4NH3+5O2
范围内,NOx的去除率迅速上升是催化剂活性随温度升高增大与温度升高共同使NOx去除反应速率迅速增大;上升缓慢阶段主要是温度升高引起NOx去除反应速率增大,但温度升高催化剂活性下降,反应温度高于380℃时,NOx的去除率迅速下降是因为可能NH3与O2反应生成了NO,其化学反应方程式为:4NH3+5O2![]() 4NO+6H2O,故答案为:迅速上升阶段是催化剂活性随温度升高增大与温度升高共同使NOx去除反应速率迅速增大;上升缓慢阶段主要是温度升高引起的NOx去除反应速率增大,催化剂活性下降;NH3与O2反应生成了NO。
4NO+6H2O,故答案为:迅速上升阶段是催化剂活性随温度升高增大与温度升高共同使NOx去除反应速率迅速增大;上升缓慢阶段主要是温度升高引起的NOx去除反应速率增大,催化剂活性下降;NH3与O2反应生成了NO。


 暑假作业海燕出版社系列答案
暑假作业海燕出版社系列答案 本土教辅赢在暑假高效假期总复习云南科技出版社系列答案
本土教辅赢在暑假高效假期总复习云南科技出版社系列答案 暑假作业北京艺术与科学电子出版社系列答案
暑假作业北京艺术与科学电子出版社系列答案科目:高中化学 来源: 题型:
【题目】某反应在体积为5L的恒容密闭的绝热容器中进行,各物质的量随时间的变化情况如图所示(已知A、B、C均为气体)。
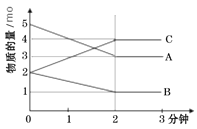
(1)该反应的化学方程式为_______。
(2)反应开始至2分钟时,B的平均反应速率为_______。
(3)由图求得平衡时A的转化率为_______。
(4)为了研究硫酸铜的量对氢气生成速率的影响,某同学设计了如下一系列的实验:将表中所给的混合溶液分别加入到6个盛有过量Zn粒的容器中,收集产生的气体,记录获得相同体积的气体所需时间。
实验混合溶液 | A | B | C | D | E | F |
4mol/L H2SO4(mL) | 30 | V1 | V2 | V3 | V4 | V5 |
饱和CuSO4溶液(mL) | 0 | 0.5 | 2.5 | 5 | V6 | 20 |
H2O(mL) | V7 | V8 | V9 | V10 | 10 | 0 |
请完成此实验设计,其中:V1=_______,V6=_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸是一种重要的化工产品,目前主要采用“接触法”进行生产。有关接触氧化反应2SO2+O2![]() 2SO3说法正确的是
2SO3说法正确的是
A.只要选择适宜的条件,SO2和O2就能全部转化为SO3
B.该反应达到平衡后,反应就完全停止了,即正逆反应速率为零
C.若用18O原子组成的O2参加反应,平衡时SO2中也会含有18O
D.在工业合成SO3时,要同时考虑反应速率和反应能达到的限度两方面的问题
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学小组构想将汽车尾气(NO、NO2)转化为重要的化工原料HNO3,其原理如图所示,其中A、B为多孔材料。下列说法正确的是( )
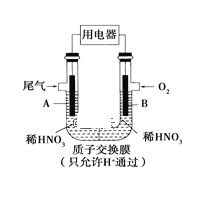
A. 电解质溶液中电流的方向由B到A
B. 电极B附近的c(NO3-)增大
C. 电极A表面反应之一为NO+2H2O-3e-===NO3-+4H+
D. 该电池工作时,每转移4 mol电子,生成22.4 L O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温时,向20mL 0.1mol/L的CH3COOH溶液中不断滴加0.1mol/L的NaOH溶液,溶液的pH变化曲线如图所示,在滴定过程中,下列关于溶液中离子浓度大小关系的描述不正确的是( )
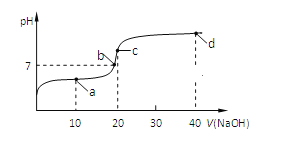
A. a点时:c(CH3COO-)>c(Na+)>c(CH3COOH)>c(H+)>c(OH-)
B. b点时:c(Na+)<c(CH3COO-)
C. c点时:c(OH-)=c(CH3COOH)+ c(H+)
D. d点时:c(Na+)>c(OH-) > c(CH3COO-)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于苯的叙述正确的是

A. 反应①为取代反应,有机产物与水混合浮在上层
B. 反应②为氧化反应,反应现象是火焰明亮并带有浓烟
C. 反应③为取代反应,有机产物是一种烃
D. 反应④中1 mol苯最多与3 mol H2发生加成反应,因为每个苯分子含有三个碳碳双键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)苯和溴的取代反应的实验装置如图所示,其中A为具支试管改制成的反应容器,在其下端开了一小孔,塞好石棉绒,再加入少量铁屑。
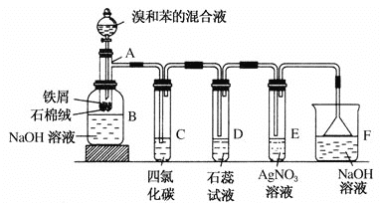
填写下列空白:
①试管A中的反应方程式为______________。
②试管C中四氯化碳的作用是:____________________________。反应开始后,观察D试管,看到的现象为:_______________。写出E中反应的离子方程式______________。
③反应2~3 min后,在B中的NaOH溶液里可观察到的现象是____________。
④在上述整套装置中,具有防倒吸功能的仪器有________(填字母)。
(2)实验室制备硝基苯的主要步骤如下:
a.配制一定比例的浓H2SO4与浓HNO3的混合酸,加入反应器中;
b.向室温下的混合酸中逐滴加入一定量的苯,充分振荡,混合均匀;
c.在55~60 ℃下发生反应,直至反应结束;
d.除去混合酸后,粗产品依次用蒸馏水和5%NaOH溶液洗涤,最后再用蒸馏水洗涤;
e.将用无水CaCl2干燥后的粗硝基苯进行蒸馏,得到纯净硝基苯。请填写下列空白:
①制备硝基苯的反应类型是________。
②配制一定比例的浓H2SO4和浓HNO3的混合酸时,操作的注意事项是:_____________。
③步骤d中洗涤、分离粗硝基苯应使用的仪器是_________________。
④步骤d中粗产品用5%NaOH溶液洗涤的目的是___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在空气中泄露的二氧化硫,会被氧化而形成硫酸雾或硫酸盐气溶胶,污染环境。工业上常用![]() 溶液吸收、活性炭还原等方法处理二氧化硫,以减小对空气的污染。
溶液吸收、活性炭还原等方法处理二氧化硫,以减小对空气的污染。
(1)写出用![]() 溶液吸收
溶液吸收![]() 的离子方程式____________。
的离子方程式____________。
(2)钠原子核外有______种能量不同的电子。写出硫原子最外层电子的轨道表示式____________。
(3)![]() 比
比![]() 稳定,请用分子结构的知识简述其理由。__________________
稳定,请用分子结构的知识简述其理由。__________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com