
【题目】(1)苯和溴的取代反应的实验装置如图所示,其中A为具支试管改制成的反应容器,在其下端开了一小孔,塞好石棉绒,再加入少量铁屑。
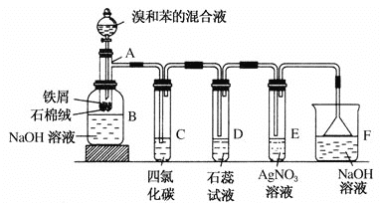
填写下列空白:
①试管A中的反应方程式为______________。
②试管C中四氯化碳的作用是:____________________________。反应开始后,观察D试管,看到的现象为:_______________。写出E中反应的离子方程式______________。
③反应2~3 min后,在B中的NaOH溶液里可观察到的现象是____________。
④在上述整套装置中,具有防倒吸功能的仪器有________(填字母)。
(2)实验室制备硝基苯的主要步骤如下:
a.配制一定比例的浓H2SO4与浓HNO3的混合酸,加入反应器中;
b.向室温下的混合酸中逐滴加入一定量的苯,充分振荡,混合均匀;
c.在55~60 ℃下发生反应,直至反应结束;
d.除去混合酸后,粗产品依次用蒸馏水和5%NaOH溶液洗涤,最后再用蒸馏水洗涤;
e.将用无水CaCl2干燥后的粗硝基苯进行蒸馏,得到纯净硝基苯。请填写下列空白:
①制备硝基苯的反应类型是________。
②配制一定比例的浓H2SO4和浓HNO3的混合酸时,操作的注意事项是:_____________。
③步骤d中洗涤、分离粗硝基苯应使用的仪器是_________________。
④步骤d中粗产品用5%NaOH溶液洗涤的目的是___________________。
【答案】![]() +Br2
+Br2![]() +HBr 除去HBr中的溴蒸气 D试管中石蕊试液慢慢变红,导管口有白雾产生 Ag++Br-=AgBr↓ 试管底部有无色油状液体 D、E、F 取代反应 先将浓硝酸注入容器中再慢慢加入浓硫酸,并及时搅拌 分液漏斗 除去粗产品中残留的酸
+HBr 除去HBr中的溴蒸气 D试管中石蕊试液慢慢变红,导管口有白雾产生 Ag++Br-=AgBr↓ 试管底部有无色油状液体 D、E、F 取代反应 先将浓硝酸注入容器中再慢慢加入浓硫酸,并及时搅拌 分液漏斗 除去粗产品中残留的酸
【解析】
(1)苯与液溴在催化剂作用下发生取代反应产生溴苯和溴化氢,B中用NaOH溶液除去溴苯中未反应的Br2单质;用有机溶剂四氯化碳除去气体中挥发的溴蒸气、苯,其中的溴化氢溶于石蕊试液,使石蕊试液变为红色;HBr还会与AgNO3溶液发生反应产生AgBr浅黄色沉淀,最后用NaOH溶液进行尾气处理,用倒扣的漏斗可以防止倒吸现象的发生。
(2)①浓硫酸与浓硝酸混合放出大量的热,配制混酸应将浓硫酸中注入浓硝酸中,及时搅拌、冷却,防止溅出伤人;
②分离互不相溶的液体,采取分液操作,需要用分液漏斗;
③制备的硝基苯中混有硫酸、硝酸,可以用5% NaOH溶液洗涤.
(1)①试管A中苯与液溴在Fe存在下发生取代反应,产生溴苯和HBr,反应的化学方程式为![]() ;
;
②试管C中四氯化碳的作用是除去HBr中的溴蒸气及苯;反应开始后,反应产生的HBr溶解在石蕊试液中,HBr溶解电离产生H+、Br-,溶液显酸性,观察D试管中溶液由紫色变为红色;逸出的HBr遇空气中的水蒸气形成HBr的小液滴,因此会看到导管口有白雾产生;在E中HBr与AgNO3溶液发生复分解反应,产生淡黄色AgBr和HNO3,反应的离子方程式为Ag++Br-=AgBr↓;
③反应2~3 min后,反应产生溴苯,未反应的单质Br2与B中的NaOH溶液发生反应产生NaBr、NaBrO和H2O,而溴苯是不能溶解于水的液体,密度比水大,故可观察到的现象是液体分层,在试管底部有无色油状液体;
④装置D和E导管口在液面上方,能防止倒吸,装置F中倒置漏斗增大了气体与氢氧化钠溶液的接触面积,有缓冲作用,能够防止倒吸,故在上述整套装置中,具有防倒吸功能的仪器有D、E、F;
(2)①苯与浓硝酸在浓硫酸存在时,在加热条件下发生取代反应产生硝基苯和水,因此制备硝基苯的反应类型是取代反应;
②浓硫酸与浓硝酸混合放出大量的热,配制混酸操作注意事项是:先将浓硝酸注入容器中,再慢慢注入浓硫酸,并及时搅拌和冷却;
③硝基苯是油状液体,与水不互溶,分离互不相溶的液态混合物,采取分液方法,需要用的玻璃仪器是分液漏斗;
④反应得到硝基苯粗产品中有残留的硝酸及硫酸,可以根据硝酸、硫酸具有酸性,能够与碱反应产生盐和水,而硝基苯不能溶于水,用氢氧化钠溶液洗涤除去粗产品中残留的酸。


 教材全解字词句篇系列答案
教材全解字词句篇系列答案科目:高中化学 来源: 题型:
【题目】实验室为测定一新配的稀盐酸的准确浓度,通常用纯净的![]() (无水)配成溶液进行滴定。称取W克纯净无水
(无水)配成溶液进行滴定。称取W克纯净无水![]() 装入锥形瓶中,加适量的蒸馏水溶解。在酸式滴定管中加入待测盐酸滴定至完全反应。
装入锥形瓶中,加适量的蒸馏水溶解。在酸式滴定管中加入待测盐酸滴定至完全反应。
(1)由于![]() 溶在溶液中会影响pH,为准确滴定,终点pH宜选在4~5之间,应选用以下三种指示剂中的____。(填序号)
溶在溶液中会影响pH,为准确滴定,终点pH宜选在4~5之间,应选用以下三种指示剂中的____。(填序号)
A.石蕊 B.甲基橙 C.酚酞
(2)滴定达到终点时溶液的颜色变化是________。写出上述滴定反应的离子方程式:_______。
(3)若达到滴定终点时,W克![]() 消耗盐酸V毫升,则盐酸的物质的量的浓度为________mol/L。
消耗盐酸V毫升,则盐酸的物质的量的浓度为________mol/L。
(4)为探讨化学平衡移动原理与氧化还原反应规律的联系,某同学通过改变浓度研究“![]() ”反应中
”反应中![]() 和
和![]() 的相互转化。实验如下:
的相互转化。实验如下:
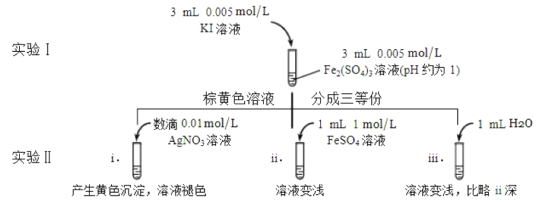
①待实验Ⅰ溶液颜色不再改变时,再进行实验Ⅱ,目的是使实验Ⅰ的反应达到_______。
②iii是ii的对比实验,目的是排除有ii中______造成的影响。
③i和ii的颜色变化表明平衡___移动(填写“正向”或“逆向”或“不”)。用化学平衡移动原理解释原因:________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学中常借助曲线图来表示某种变化过程,有关下列四个曲线图的说法正确的是
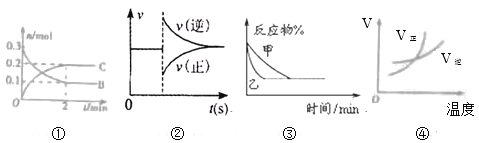
A.对反应:aA(s)+2B(g)![]() xC(g),根据图①可以求出x=3
xC(g),根据图①可以求出x=3
B.图②可以表示对某化学平衡体系改变温度后反应速率随时间的变化
C.图③表示压强对可逆反应2A(g)+2B(g)![]() 3C(g)+D(g)的影响,乙的压强大
3C(g)+D(g)的影响,乙的压强大
D.升高温度,图④表示的反应中反应物的的转化率减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NOx(主要指NO和NO2)是大气主要污染物之一。有效去除大气中的NOx是环境保护的重要课题。
在有氧条件下,新型催化剂M能催化NH3与NOx反应生成N2。
将一定比例的O2、NH3和NOx的混合气体,匀速通入装有催化剂M的反应器中反应。
反应相同时间NOx的去除率随反应温度的变化曲线如图所示,在50~250℃范围内随着温度的升高,NOx的去除率先迅速上升后上升缓慢的主要原因是___;当反应温度高于380℃时,NOx的去除率迅速下降的原因可能是__。
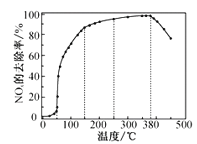
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】右图为实验室制取乙炔并验证其性质的装置图。下列说法不合理的是

A.逐滴加入饱和食盐水可控制生成乙炔的速率
B.KMnO4酸性溶液褪色,说明乙炔具有还原性
C.用Br2的CCl4溶液验证乙炔的性质,不需要除杂
D.将纯净的乙炔点燃,有浓烈的黑烟,说明乙炔不饱和程度高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)赤水晒醋是我们遵义特产之一,其中含有一定量的CH3COOH。写出CH3COOH的电离方程式 ______;在已达平衡的乙酸溶液中加入一定的CH3COONa ,该溶液pH_______(填“增大”“减小”或“不变”)。
(2)燃料电池汽车,尤其是氢燃料电池汽车可以实现零污染、零排放,驱动系统几乎无噪音,且氢能取之不尽、用之不竭,因此燃料电池汽车成为汽车企业关注的焦点。燃料电池的燃料可以是氢气、甲醇等。有科技工作者利用稀土金属氧化物作为固体电解质制造出了甲醇—空气燃料电池。这种稀土金属氧化物在高温下能传导O2-。
①该电池的正极反应是___________;负极反应是____________。
②在稀土氧化物的固体电解质中,O2-的移动方向是__________。
③甲醇可以在内燃机中燃烧直接产生动力推动机动车运行,而科技工作者要花费大量的精力研究甲醇燃料汽车,主要原因是___________。
(3)在AgCl的饱和溶液中存在沉淀溶解平衡:AgCl(s) ![]() Ag+(aq)+Cl-(aq),在25℃时,Ksp(AgCl)=1.8×10-10。现将足量氯化银分别放入:
Ag+(aq)+Cl-(aq),在25℃时,Ksp(AgCl)=1.8×10-10。现将足量氯化银分别放入:
①100 mL蒸馏水中;②100 mL 0.2 mol/L AgNO3溶液中;③100 mL 0.1 mol/L氯化铝溶液中;④100 mL 0.1 mol/L盐酸中,充分搅拌后,相同温度下c(Ag+)由大到小的顺序是_____(填写序号);其中②中氯离子的浓度为______mol/L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外活动小组用如图所示的实验装置探究氯气与氨气之间的反应。其中A、F为氨气和氯气的发生装置,C为纯净、干燥的氯气与氨气反应的装置。
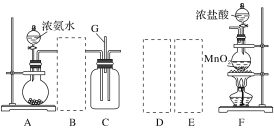
备选装置 | ||
|
|
|
Ⅰ | Ⅱ | Ⅲ |
请回答下列问题:
(1)装置F中发生反应的离子方程式是___________________________________。
(2)装置A中的烧瓶内固体可选用________(填字母)。
A.碱石灰 B.浓硫酸 C.生石灰 D.五氧化二磷 E.烧碱
(3)虚线框内应添加必要的除杂装置,请从如图的备选装置中选择,并将编号填入下列空格:
B:________、D:________、E:________。
(4)氯气和氨气在常温下混合就能发生反应生成氯化铵和氮气,该反应的化学方程式为:____________________________________;
(5)装置C内出现浓厚的白烟并在容器内壁凝结,请设计一个实验方案确定该白色固体中的阳离子:_______________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有机物相关描述不正确的
A.用溴水能区分乙酸、己烯、苯、四氯化碳
B.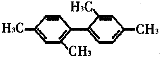 分子中至少有11个碳原子处于同一平面上
分子中至少有11个碳原子处于同一平面上
C.甘氨酸(H2N—CH2COOH)、丙氨酸[CH3CH(NH2)COOH]、谷氨酸[HOOC—CH2CH2CH(NH2)COOH]一定条件下形成链状三肽的结构最多有3种
D.1mol有机物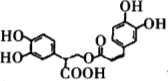 一定条件下能和6molNaOH反应。
一定条件下能和6molNaOH反应。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有人尝试用工业制纯碱原理来制备![]() 。他向饱和
。他向饱和![]() 溶液中依次通入足量的______和______两种气体,充分反应后有白色晶体析出。将得到的白色晶体洗涤后灼烧,结果无任何固体残留,且产生的气体能使澄清石灰水变浑浊。写出生成白色晶体的化学方程式:________。分析该方法得不到
溶液中依次通入足量的______和______两种气体,充分反应后有白色晶体析出。将得到的白色晶体洗涤后灼烧,结果无任何固体残留,且产生的气体能使澄清石灰水变浑浊。写出生成白色晶体的化学方程式:________。分析该方法得不到![]() 的原因可能是_______________。
的原因可能是_______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com