
【题目】某100mL稀溶液中只含有Fe3+、Cu2+、H+、NO3-四种离子,向其中逐渐加入铁粉,溶液中Fe2+的浓度和加入铁粉的质量的关系如图所示,若整个反应过程中溶液的体积不发生变化,则下列说法中不正确的是

A. 原溶液的c(H+)=4mol·L—1
B. 若a=3,则原溶液中c(Cu2+)=1mol·L—1
C. 原溶液中的c(NO3-)=7mol·L-1
D. BC段发生反应的离子方程式为Cu2++Fe=Fe2++Cu
【答案】C
【解析】A.OA段无Fe2+生成,是加入的5.6g即0.1mol铁粉与硝酸反应:Fe+4H++NO3-=Fe3++NO↑+2H2O,设溶液中的氢离子的物质的量为xmol,则有:
Fe+4H++NO3-=Fe3++NO↑+2H2O
1 4
0.1mol xmol
则有: ![]()
解得x=0.4mol 则溶液中的氢离子的物质的量浓度c=![]() =4mol/L,故A正确;B.若a=3,则说明在BC段生成的Fe2+的物质的量为n=0.1mol,而BC段发生的反应为Fe+Cu2+=Cu+Fe2+,设溶液中的Cu2+的物质的量为ymol,则有:
=4mol/L,故A正确;B.若a=3,则说明在BC段生成的Fe2+的物质的量为n=0.1mol,而BC段发生的反应为Fe+Cu2+=Cu+Fe2+,设溶液中的Cu2+的物质的量为ymol,则有:
Fe+Cu2+=Cu+Fe2+
1 1
ymol 0.1mol
则有: ![]() ,
,
则有:y=0.1mol,则溶液中的铜离子的物质的量浓度c=![]() =1mol/L,故B正确;C.C点溶液中c(Fe2+)=4mol/L,故此时溶液中的n(Fe2+)=CV=4mol/L×0.1L=0.4mol,而此时溶液中溶质为Fe(NO3)2,故C点溶液中的n(NO3-)=0.8mol,而在OA段加入0.1mol铁反应时,消耗掉的硝酸根为0.1mol,故原溶液中的n(NO3-)总=0.8mol+0.1mol=0.9mol,故浓度为c(NO3-)总=
=1mol/L,故B正确;C.C点溶液中c(Fe2+)=4mol/L,故此时溶液中的n(Fe2+)=CV=4mol/L×0.1L=0.4mol,而此时溶液中溶质为Fe(NO3)2,故C点溶液中的n(NO3-)=0.8mol,而在OA段加入0.1mol铁反应时,消耗掉的硝酸根为0.1mol,故原溶液中的n(NO3-)总=0.8mol+0.1mol=0.9mol,故浓度为c(NO3-)总=![]() =9mol/L,故C错误;D.BC段,加入的铁粉和Cu2+反应:Fe+Cu2+=Cu+Fe2+,故D正确;故选C。
=9mol/L,故C错误;D.BC段,加入的铁粉和Cu2+反应:Fe+Cu2+=Cu+Fe2+,故D正确;故选C。


科目:高中化学 来源: 题型:
【题目】下列关于氯元素及氯气的叙述中,正确的是( )
A.干燥的氯气可以贮存在钢瓶中
B.氯元素在自然界中既有化合态存在,也有游离态存在
C.氯气难溶于水,可直接用排水法收集氯气
D.氯水、液氯是状态不同的同一种物质,均属于纯净物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据要求完成下列实验。(a、b 为弹簧夹,其他装置略去)
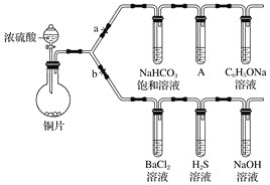
(一)验证酸性的相对强弱:碳酸>苯酚。(已知酸性:亚硫酸 >碳酸)
(1)铜与浓硫酸反应的化学方程式是________________________________,装置A中的足量的试剂是______________。
(2)连接仪器、________、加药品后,打开a关闭 b,然后滴入浓硫酸,加热。能说明碳酸的酸性比苯酚酸性强的实验现象是:________________。
(二)验证SO2具有氧化性、还原性和酸性氧化物的通性。
(3)打开b,关闭a。能验证SO2具有氧化性的化学方程式是________________。
(4)若过量的SO2通入NaOH溶液中,其化学方程式是:________________。
(5)BaCl2溶液中无任何现象,将其分成两份,分别滴加氨水和氯水,均产生白色沉淀,沉淀化学式分别是________________,________________。
(6)写出其中SO2显示还原性并生成白色沉淀的总的离子方程式________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为氢氧燃料电池原理示意图,按照此图的提示,下列叙述不正确的是

A. a电极是负极
B. b电极的电极反应为:4OH--4e-=2H2O+O2↑
C. 氢氧燃料电池是一种具有应用前景的绿色电源
D. 氢氧燃料电池是一种不需要将还原剂和氧化剂全部储藏在电池内的新型发电装置
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于苯的说法中,错误的是( )
A.苯的密度比水小且不溶于水,故将苯滴在溴水中苯在上层,上层无色下层橙色。
B.苯是很好的有机溶剂,它及其同系物常做油漆的溶剂
C.苯易燃,易挥发,所以在储运过程中要注意防火
D.苯是一种重要的化工原料,主要来自于煤的干馏
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生为测定某烧碱样品中![]() 的质量分数,进行如下实验:(已知该样品中含有少量不与酸作用的杂质)
的质量分数,进行如下实验:(已知该样品中含有少量不与酸作用的杂质)
A.在250![]() 的容量瓶中定容,配制成250
的容量瓶中定容,配制成250![]() 烧碱溶液;
烧碱溶液;
B.用碱式滴定管移取25.00![]() 烧碱溶液于锥形瓶中,并滴几滴甲基橙指示剂;
烧碱溶液于锥形瓶中,并滴几滴甲基橙指示剂;
C.在天平上准确称取20.5![]() 烧碱样品,在烧杯中用蒸馏水溶解;
烧碱样品,在烧杯中用蒸馏水溶解;
D.将物质的量浓度为1.00![]() 的标准硫酸溶液装入酸式滴定管中,调节液面,记下开始时的读数;
的标准硫酸溶液装入酸式滴定管中,调节液面,记下开始时的读数;
E.在锥形瓶下垫一张白纸,滴定至溶液变为橙色为止,记下读数。
试填空:
(1)正确操作步骤的顺序是________→________→________→________→________。(用字母填空)
(2)观察滴定管液面的读数时应注意什么问题?
_____________________________________________________________________。
(3)![]() 步操作中的锥形瓶下垫一张白纸的作用是__________________________________________。
步操作中的锥形瓶下垫一张白纸的作用是__________________________________________。
(4)下列操作中可能使所测![]() 溶液的质量分数偏低的是________。
溶液的质量分数偏低的是________。
a.![]() 步操作中未将溶液冷却至室温就转移到容量瓶中定容
步操作中未将溶液冷却至室温就转移到容量瓶中定容
b.![]() 步操作中,称量药品时,砝码放在左盘,
步操作中,称量药品时,砝码放在左盘,![]() 放在右盘
放在右盘
c.![]() 步操作中酸式滴定管在装入标准
步操作中酸式滴定管在装入标准![]() 溶液前未用标准液润洗
溶液前未用标准液润洗
d.滴定过程中,读取硫酸溶液体积时,开始时仰视读数,结束时俯视读数
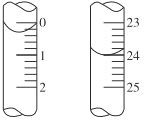
(5)硫酸的初读数和末读数如图所示。未读数为________![]() ,初读数为________
,初读数为________![]() ,用量为________
,用量为________![]() 。按滴定所得数据计算烧碱样品中
。按滴定所得数据计算烧碱样品中![]() 的质量分数为________。
的质量分数为________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com