
A.一定是离子键 B.一定是共价键
C.可能是离子键,也可能是共价键 D.以上说法都不正确
科目:高中化学 来源: 题型:阅读理解
| 电离能(kJ/mol) | I1 | I2 | I3 | I4 |
| A | 932 | 1821 | 15390 | 21771 |
| B | 738 | 1451 | 7733 | 10540 |
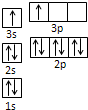
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解



| 电离能I(eV) | A | B | C | D | E | F |
| I1 | 11.3 | 14.5 | 13.6 | 5.2 | 7.6 | 6.0 |
| I2 | 24.4 | 29.6 | 35.1 | 49.3 | 15.0 | 18.8 |
| I3 | 47.9 | 47.4 | 54.9 | 71.6 | 80.1 | 28.4 |
| I4 | 64.5 | 77.5 | 77.4 | 98.9 | 109.2 | 112.0 |
| I5 | 392.1 | 97.9 | 113.9 | 138.3 | 141.3 | 153.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解


| YO2 | YO3 | |
| 空气 | 94%~95% | 5%~6% |
| 氧气 | 97%~98% | 2%~3% |
查看答案和解析>>
科目:高中化学 来源: 题型:
A.L层电子为偶数的所有元素所在族序数与该元素原子的L层电子数相等
B.短周期元素中,某元素的原子最外层电子数为次外层电子数的2倍,则该元素可能是碳元素
C.只要是离子化合物,其熔点一定比共价化合物高
D.含极性键的化合物不一定是共价化合物
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com