
【题目】下列关于有机化合物的说法正确的是
A. 制备聚四氟乙烯的单体属于不饱和烃
B. 分子式为C4H10O的醇有4种同分异构体
C. 苯乙烯(![]() )分子的所有原子不可能在同一平面上
)分子的所有原子不可能在同一平面上
D. 异丁烯及甲苯均能使溴水褪色,且褪色原理相同
【答案】B
【解析】A,聚四氟乙烯的结构简式为![]() ,其单体为CF2=CF2,CF2=CF2属于氟代烃,A项错误;B,分子式为C4H10O的醇的同分异构体有CH3CH2CH2CH2OH、CH3CH2CH(OH)CH3、(CH3)2CHCH2OH、
,其单体为CF2=CF2,CF2=CF2属于氟代烃,A项错误;B,分子式为C4H10O的醇的同分异构体有CH3CH2CH2CH2OH、CH3CH2CH(OH)CH3、(CH3)2CHCH2OH、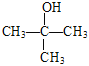 ,共4种,B项正确;C,苯乙烯由苯基和乙烯基通过碳碳单键相连,苯基中与苯环碳原子直接相连的原子共平面(联想苯的结构),乙烯基中与碳碳双键直接相连的原子共平面(联想乙烯的结构),由于单键可以旋转,苯基的平面与乙烯基的平面可能共平面,苯乙烯分子中所有原子可能在同一平面上,C项错误;D,异丁烯使溴水褪色是异丁烯与溴水发生了加成反应,甲苯使溴水褪色是甲苯将溴从溴水中萃取出来,褪色原理不同,D项错误;答案选B。
,共4种,B项正确;C,苯乙烯由苯基和乙烯基通过碳碳单键相连,苯基中与苯环碳原子直接相连的原子共平面(联想苯的结构),乙烯基中与碳碳双键直接相连的原子共平面(联想乙烯的结构),由于单键可以旋转,苯基的平面与乙烯基的平面可能共平面,苯乙烯分子中所有原子可能在同一平面上,C项错误;D,异丁烯使溴水褪色是异丁烯与溴水发生了加成反应,甲苯使溴水褪色是甲苯将溴从溴水中萃取出来,褪色原理不同,D项错误;答案选B。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】下列关于物质特殊聚集状态结构的叙述中,错误的是( )
A.等离子体的基本构成微粒的排列是带电的离子和电子及不带电的分子或原子
B.非晶体基本构成微粒的排列是长程无序和短程有序的
C.液晶内部分子沿分子长轴方向有序排列,使液晶具有各向异性
D.纳米材料包括纳米颗粒与颗粒间的界面两部分,两部分都是长程有序的
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于下列装置说法正确的是( )

A. 装置①中,盐桥中的K+移向ZnSO4溶液
B. 滴有酚酞溶液的装置②在电解过程中,b极先变红
C. 可以用装置③在铁上镀铜,d极为铜
D. 装置④中发生铁的吸氧腐蚀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度时,在2L的容器中,X、Y、Z三种气体的物质的量随时间的变化曲线如图所示。请通过计算回答下列问题。
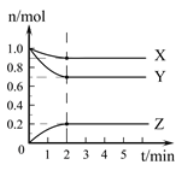
(1)反应开始至2 mim,Y的平均反应速率_________。
(2)分析有关数据,写出X、Y、Z的反应方程式______________________________。
(3)当反应进行了3 min,该反应是否达到平衡___________(填“是”或“否”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】滴定实验是化学学科中重要的定量实验。
已知某NaOH试样中含有NaCl杂质,为测定试样中NaOH的质量分数,进行如下实验:
①称量1.0g样品溶于水,配成250 mL溶液;
②准确量取25.00mL所配溶液于锥形瓶中;
③滴加几滴酚酞溶液;
④用0.1000mol/L的标准盐酸滴定三次,每次消耗盐酸的体积记录如下:
滴定序号 | 待测液体积(mL) | 所消耗标准盐酸的体积(mL) | |
滴定前 | 滴定后 | ||
1 | 25.00 | 0.50 | 20.60 |
2 | 25.00 | 6.00 | 26.00 |
3 | 25.00 | 1.10 | 21.00 |
请回答下列问题:
(1)滴定终点时的现象是_______________________________________。
(2)所配制的250 mL样品液中NaOH的物质的量浓度是_________ mol·L-1;试样中NaOH的质量分数为__________________。
(3)若出现下列情况,测定结果偏高的是___________。
a.滴定前用蒸馏水冲洗锥形瓶
b.在摇动锥形瓶时不慎将瓶内溶液溅出
c.滴定前有气泡,滴定后气泡消失
d.酸式滴定管滴至终点对,俯视读数
e.酸式滴定管用蒸馏水洗后,未用标准液润洗
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对含氮物质的研究和利用有着极为重要的意义。
(1)N2、O2和H2相互之间可以发生化合反应,已知反应的热化学方程式如下:
N2(g)+O2(g)=2NO(g) ![]() H= +180 kJ·mol-1;
H= +180 kJ·mol-1;
2H2(g)+O2(g)=2H2O(g) ![]() H =-483 kJ·mol-1;
H =-483 kJ·mol-1;
N2(g)+3H2(g)=2NH3(g) ![]() H = -93 kJ·mol-1。
H = -93 kJ·mol-1。
则氨的催化氧化反应的热化学方程式为___________________________________。
(2)汽车尾气净化的一个反应原理为:2NO(g)+2CO(g)![]() N2(g)+2CO2(g) △H<0。一定温度下,将2.8mol NO、2.4mol CO通入固定容积为2L的密闭容器中,反应过程中部分物质的物质的量变化如右图所示。
N2(g)+2CO2(g) △H<0。一定温度下,将2.8mol NO、2.4mol CO通入固定容积为2L的密闭容器中,反应过程中部分物质的物质的量变化如右图所示。

①NO的平衡转化率为_________,0~20min平均反应速率v(NO)为_____________mol/(L![]() min);该温度下的化学平衡常数数值是_____________。25min时,若保持反应温度不变,再向容器中充入CO、N2各0.8 mol,则化学平衡将_________ 移动(填“向左”、“向右”或“不”)。
min);该温度下的化学平衡常数数值是_____________。25min时,若保持反应温度不变,再向容器中充入CO、N2各0.8 mol,则化学平衡将_________ 移动(填“向左”、“向右”或“不”)。
②下列可说明该反应已经达到平衡的是__________。
a. v生成(CO2)= v消耗(CO)
b.混合气体的密度不再改变
c.混合气体的平均相对分子质量不再改变
d.单位时间内消耗2n mol CO2的同时生成n mol N≡N
e.NO、CO、N2、CO2的浓度相等
③反应达到平衡后,改变某一个条件,下列示意图曲线①⑧中正确的是________

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把下列现象中硫酸所表现出来的性质填写在空白处:
(1)把锌粒放入稀硫酸中时,有气体放出 _____________;
(2)盛有浓硫酸的烧杯敞口放置一段时间后,质量增加 _____________;
(3)用玻璃棒蘸浓硫酸滴在纸上时,纸变黑 _____________;
(4)把木炭放入热的浓硫酸中时,有气体放出 _____________;
(5)在常温下可以用铁、铝制容器盛装冷的浓硫酸 _____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是
A. 将稀氨水逐滴加入稀硫酸中,当溶液pH=7时,c(SO42-)>c(NH4+)
B. 两种醋酸溶液的物质的量浓度分别为c1和c2,pH分别为a和a+1,则c1=10c2
C. pH=11的NaOH溶液与pH=3的醋酸溶液等体积混合,滴入石蕊溶液呈红色
D. 向0.1mol/L的氨水中加入少量硫酸铵固体,则溶液中c(OH-)/c(NH3·H2O)增大
【答案】C
【解析】由电荷守恒可知c(NH4+)+c(H+)=2c(SO42-)+c(OH-),当pH=7时,c(NH4+)=2c(SO42-),故A项错;醋酸是弱酸,浓度越大,电离程度越小,当两溶液pH相差1时,c1≠10c2,B项错;pH=11的NaOH与pH=3的醋酸等体积混合后溶液显酸性,滴入石蕊试液呈红色,C项对;氨水存在电离平衡:NH3·H2ONH4++OH-,加(NH4)2SO4固体,平衡左移,导致 减小,D项错。
减小,D项错。
【题型】单选题
【结束】
20
【题目】常温下,将等体积,等物质的量浓度的NH4HCO3与NaCl溶液混合,析出部分NaHCO3晶体,过滤,所得滤液pH<7。下列关于滤液中的离子浓度关系不正确的是
A.  <1.0×10-7mo1/L
<1.0×10-7mo1/L
B. c(Na+)=c(HCO3-)+c(CO32-)+c(H2CO3)
C. c(H+)+c(NH4+)>c(OH-)+c(HCO3-)+2c(CO32-)
D. c(Cl-)>c(HCO3-)>c(NH4+)>c(CO32-)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com