
| 分组 | 实验方案 | pH或实验现象 |
| 甲组 | 常温下,取等体积、物质的量浓度均为0.1mol.L-1的硫酸和亚硫酸,分别加入过量表面积相同,经砂纸打磨过的镁条,收集产生的气体 | |
| 乙组 | 将SO3(g)和SO2(g)分别通入水中,立即测量所得两溶液的pH | 所得硫酸的pH小于亚硫酸 |


 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案科目:高中化学 来源: 题型:
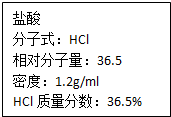 如图为实验室某浓盐酸试剂瓶上的标签,试根据有关数据回答下列问题:
如图为实验室某浓盐酸试剂瓶上的标签,试根据有关数据回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
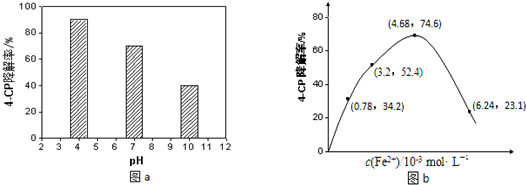
科目:高中化学 来源: 题型:
| H+/H2O |

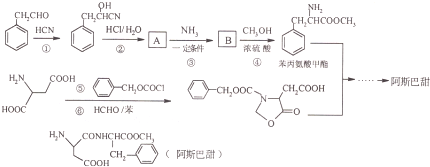
 的合成路线流程(无机试剂任选).合成路线流程示例如下
的合成路线流程(无机试剂任选).合成路线流程示例如下 :
:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com