
【题目】1.92g铜投入一定量的浓硝酸中,铜完全溶解,生成气体颜色越来越浅,共收集到672 mL气体(标准状况),将盛有此气体的容器倒扣在水中,通入氧气恰好使气体完全溶解在水中,则需要标准状况下的氧气体积为( )
A.504 mL B.168 mL C.224mL D.336 mL
 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案科目:高中化学 来源: 题型:
【题目】科学研究发现,苹果含有微量元素Zn,而锌是构成与记忆力息息相关的核酸和蛋白质不可缺少的元素。儿童缺锌就会导致大脑发育不良,因此苹果又被称为记忆之果。这说明无机盐离子
A. 对维持酸碱平衡有重要作用
B. 对维持细胞形态有重要作用
C. 对调节细胞内的渗透压有重要作用
D. 对维持生物体的生命活动有重要作用
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图中A~H均为中学化学中常见的物质,A、B、H是气体,它们之间有如下转化关系(反应中生成的水已略去)。
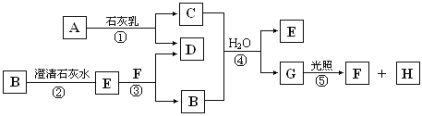
请回答以下问题:
(1)E是 (填化学式),G是 (填名称);
(2)C物质在日常生活中可作 ;
(3)写出反应①的化学方程式 ;
C与浓盐酸反应,可以生成A气体,写出反应的化学方程式 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳酸锂广泛应用于陶瓷和医药等领域,以锂辉石(主要成分为LiAlSi2O6)为原材料制备Li2CO3的工艺流程如下:
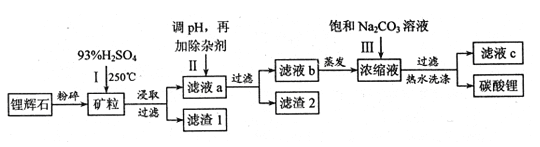
已知①2LiAlSi2O6+H2SO4![]() Li2SO4+Al2O34SiO2H2O
Li2SO4+Al2O34SiO2H2O
②Fe3+、Al3+、Fe2+和Mg2+以氢氧化物形式完全沉淀时,溶液的pH分别为3.2、4.7、9.0和11.1
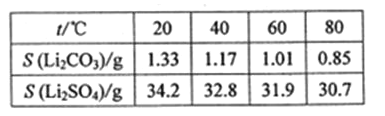
③某些物质的溶解度(S)如下表
请回答下列问题:
(1)锂辉石用浓硫酸浸取之前要粉碎成细颗粒的目的是 。
(2)滤液a中含有Li+、SO42-,另含有Fe3+、Al3+、Fe2+、 Mg2+ 、Ca2+ 、Na+等杂质,步骤Ⅱ需在搅拌下加入石灰石以调节溶液的pH到6.0—6.5,此时沉淀的杂质离子有 ;石灰石调节溶液pH的原理的离子方程式为 。
(3)步骤Ⅱ在滤液a中加入的除杂剂依次为适量的H2O2溶液,石灰乳和Na2CO3溶液,发生氧化还原反应的离子方程式为 。
(4)步骤Ⅲ中加入饱和Na2CO3溶液过滤后需要用热水洗涤的原因是 。
(5)从滤液c中可回收的主要物质是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】联氨(又称肼,N2H4,无色液体)是一种应用广泛的化工原料,可用作火箭燃料,回答下列问题:
(1)联氨分子的电子式为_____________。
(2)①2O2(g)+N2(g)=N2O4(l) ΔH1
②N2(g)+2H2(g)=N2H4(l) ΔH2
③O2(g)+2H2(g)=2H2O(g) ΔH3
④2N2H4(l) + N2O4(l)= 3N2(g)+ 4H2O(g) ΔH4=-1048.9kJ/mol
上述反应热效应之间的关系式为ΔH4=__________,联氨和N2O4可作为火箭推进剂的主要原因为______________。
(3)联氨为二元弱碱,在水中的电离方式与氨相似,联氨第一步电离方程式为:_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分枝酸可用于生化研究.其结构简式如图.下列关于分枝酸的叙述正确的是( )

A.1mol分枝酸最多可与3molNaOH发生中和反应
B.可与乙醇、乙酸反应,且反应类型相同
C.分子中含有2 种官能团
D.可使溴的四氯化碳溶液、酸性高锰酸钾溶液褪色.且原理相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于糖类、脂肪和蛋白质的叙述正确的是
A. 蛋白质溶液遇CuSO4后产生的沉淀能重新溶解 B. 淀粉水解的最终产物是葡萄糖
C. 葡萄糖能发生氧化反应和水解反应 D. 植物油不能使溴的四氯化碳溶液褪色
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com