
����Ŀ��һЩ��ҵ�ķ�ˮ�а����������س��꣬��ˮ�ѵ��ѳ�Ϊ��Ҫ��Ⱦ����ź�ˮ�帻Ӫ�������ε��о��ȵ㣬�ж��ַ�������ȥ����
I�������ҵ��ˮ�����������£�
(1)���ѷ���������ˮ�еİ����������![]() ������̬��
������̬��![]() ����ƽ��״̬�����ڡ�������ֱ��ͨ��ˮ�У�ʹ�����Һ���ֽӴ���ˮ���ܽ�����백������Һ���棬������ת�ƣ��Ӷ��ﵽ�ѳ�����Ŀ�ġ�������ˮ��
����ƽ��״̬�����ڡ�������ֱ��ͨ��ˮ�У�ʹ�����Һ���ֽӴ���ˮ���ܽ�����백������Һ���棬������ת�ƣ��Ӷ��ﵽ�ѳ�����Ŀ�ġ�������ˮ��![]() ��
��![]() ƽ��̬��ƽ���ϵ��________��
ƽ��̬��ƽ���ϵ��________��
(2)�¶ȡ�![]() ֵ�������������ѳ����кܴ��Ӱ�졣
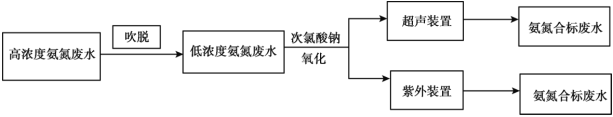
ֵ�������������ѳ����кܴ��Ӱ�졣![]() ֵ�������������ѳ���Ӱ����ͼ��ʾ����ͼ���Կ�������������һ��ʱ��
ֵ�������������ѳ���Ӱ����ͼ��ʾ����ͼ���Կ�������������һ��ʱ��![]() ʱ������������
ʱ������������![]() ���Ӷ����ӣ����û�ѧƽ���ƶ�ԭ������ԭ��________��
���Ӷ����ӣ����û�ѧƽ���ƶ�ԭ������ԭ��________��
(3)�������������������ô�������������ˮ�а��������ӷ���ʽ��________��
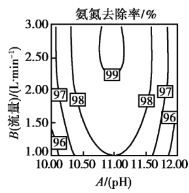
II�����ں���![]() �İ�����ˮ�������õ绯ѧ��������������Эͬȥ��ˮ�еİ�����װ����ͼ��ʾ���������У�ʯīձ�缫����
�İ�����ˮ�������õ绯ѧ��������������Эͬȥ��ˮ�еİ�����װ����ͼ��ʾ���������У�ʯīձ�缫����![]() ����ͨ��
����ͨ��![]() ��������ֲ���
��������ֲ���![]() ��������ˮ�е�
��������ˮ�е�![]() ��ͬʱ
��ͬʱ![]() ������ͨ������
������ͨ������![]() ��������������ȥ��
��������������ȥ��
(1)�����ĵ缫��Ӧʽ��________��
(2)��ˮ�е�![]() ת��Ϊ
ת��Ϊ![]() �����ӷ���ʽ��________��
�����ӷ���ʽ��________��
(3)![]() ����
����![]() ������
������![]() �����ɣ�ԭ����________��
�����ɣ�ԭ����________��
���𰸡�![]() NH3+H2O
NH3+H2O![]() +OH-��c(OH-)����������ƽ�������ƶ���
+OH-��c(OH-)����������ƽ�������ƶ���![]() ת��Ϊ����̬��NH3��NH3�ڿ��������´�ˮ���ѳ�
ת��Ϊ����̬��NH3��NH3�ڿ��������´�ˮ���ѳ� ![]()
![]()
![]()
![]() ����
����![]() ʱ��
ʱ��![]() ��
��![]() ����
����![]() �������
�������![]() ��
��![]() �ĵ��뱻���ƣ�ʹ
�ĵ��뱻���ƣ�ʹ![]() ��
��![]() Ũ�Ƚ��ͣ�������
Ũ�Ƚ��ͣ�������![]() ������
������
��������
��(1)NH3����H2O����NH3H2O��NH3H2O���ֵ�������![]() ��OH-��
��OH-��
(2)������Һ������Զ�NH3+H2O![]() +OH-��Ӱ��������
+OH-��Ӱ��������
(3)NaClO����ǿ�����ԣ���������ԭ������![]() ����N2��ͬʱClO-����ԭ����Cl-��
����N2��ͬʱClO-����ԭ����Cl-��
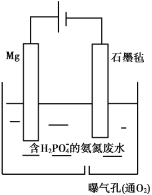
��(1)Mg�ǻ��ý��������ý���������ʱ����������ʧ���ӷ���������Ӧ���ݴ���д�缫��Ӧʽ��
(2) ![]() ��
��![]() ��Mg2+��OH-��H2O��Ӧ����������MgNH4PO46H2O���Ӷ���ȥ��Һ��
��Mg2+��OH-��H2O��Ӧ����������MgNH4PO46H2O���Ӷ���ȥ��Һ��![]() ��
��
(3) ![]() ����
����![]() ʱ����Һ��c(OH-)�ϴ�
ʱ����Һ��c(OH-)�ϴ�![]() ��Mg2+����OH-�������NH3H2O��Mg(OH)2�����(2)��Ӧ����ʽ�������
��Mg2+����OH-�������NH3H2O��Mg(OH)2�����(2)��Ӧ����ʽ�������
��(1)NH3����H2O����NH3H2O��NH3H2O���ֵ�������![]() ��OH-��������Һ�д����ܽ�͵���ƽ�⣬��������ˮ��NH3��
��OH-��������Һ�д����ܽ�͵���ƽ�⣬��������ˮ��NH3��![]() ƽ��̬��ƽ���ϵ��NH3+H2ONH3H2O
ƽ��̬��ƽ���ϵ��NH3+H2ONH3H2O![]() +OH-���ʴ�Ϊ��NH3+H2ONH3H2O
+OH-���ʴ�Ϊ��NH3+H2ONH3H2O![]() +OH-��
+OH-��
(2)NH3+H2O![]() +OH-����Һ��pHֵԽ����Һ��c(OH-)Խ��ƽ��Խ���������ƶ���ʹ
+OH-����Һ��pHֵԽ����Һ��c(OH-)Խ��ƽ��Խ���������ƶ���ʹ![]() ת��Ϊ����̬��NH3��NH3�ڿ��������´�ˮ���ѳ������Կ�������һ��ʱ��10��pH��11ʱ������������pH���Ӷ����ӣ��ʴ�Ϊ��NH3+H2O
ת��Ϊ����̬��NH3��NH3�ڿ��������´�ˮ���ѳ������Կ�������һ��ʱ��10��pH��11ʱ������������pH���Ӷ����ӣ��ʴ�Ϊ��NH3+H2O![]() +OH-��c(OH-)����������ƽ�������ƶ���
+OH-��c(OH-)����������ƽ�������ƶ���![]() ת��Ϊ����̬��NH3��NH3�ڿ��������´�ˮ���ѳ���
ת��Ϊ����̬��NH3��NH3�ڿ��������´�ˮ���ѳ���
(3)NaClO����ǿ�����ԣ���������ԭ������![]() ����N2��ͬʱClO-����ԭ����Cl-�����ӷ���ʽΪ2
����N2��ͬʱClO-����ԭ����Cl-�����ӷ���ʽΪ2![]() +3ClO- +2OH- �TN2+3Cl- +5H2O���ʴ�Ϊ��2
+3ClO- +2OH- �TN2+3Cl- +5H2O���ʴ�Ϊ��2![]() +3ClO- +2OH- �TN2+3Cl- +5H2O��
+3ClO- +2OH- �TN2+3Cl- +5H2O��
��(1)Mg�ǻ��ý��������ý���������ʱ�������Ͻ���ʧ�������ɽ��������ӣ����������ĵ缫��ӦʽΪMg-2e- =Mg2+���ʴ�Ϊ��Mg-2e- =Mg2+��
(2) ![]() ��
��![]() ��Mg2+��OH-��H2O��Ӧ����������MgNH4PO46H2O���Ӷ���ȥ��Һ�е�
��Mg2+��OH-��H2O��Ӧ����������MgNH4PO46H2O���Ӷ���ȥ��Һ�е�![]() ����Ӧ�����ӷ���ʽΪ
����Ӧ�����ӷ���ʽΪ![]() +
+![]() +Mg2++2OH- +4H2O=MgNH4PO46H2O���ʴ�Ϊ��
+Mg2++2OH- +4H2O=MgNH4PO46H2O���ʴ�Ϊ��![]() +
+![]() +Mg2++2OH- +4H2O=MgNH4PO46H2O��
+Mg2++2OH- +4H2O=MgNH4PO46H2O��
(3) ![]() ����
����![]() ʱ����Һ��c(OH-)�ϴ�
ʱ����Һ��c(OH-)�ϴ�![]() ��Mg2+����OH-�������NH3H2O��Mg(OH)2��NH3H2O�ĵ��뱻���ƣ�ʹ
��Mg2+����OH-�������NH3H2O��Mg(OH)2��NH3H2O�ĵ��뱻���ƣ�ʹ![]() ��Mg2+Ũ�Ƚ��ͣ�������MgNH4PO46H2O�����ɣ��ʴ�Ϊ��
��Mg2+Ũ�Ƚ��ͣ�������MgNH4PO46H2O�����ɣ��ʴ�Ϊ��![]() ����
����![]() ʱ��
ʱ��![]() ��Mg2+����OH-�������NH3H2O��Mg(OH)2��NH3H2O�ĵ��뱻���ƣ�ʹ
��Mg2+����OH-�������NH3H2O��Mg(OH)2��NH3H2O�ĵ��뱻���ƣ�ʹ![]() ��Mg2+Ũ�Ƚ��ͣ�������MgNH4PO46H2O�����ɡ�
��Mg2+Ũ�Ƚ��ͣ�������MgNH4PO46H2O�����ɡ�


 �����ܿ����ϵ�д�
�����ܿ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
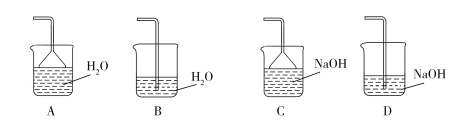
����Ŀ����MgSO4��Al2(SO4)3�Ļ����Һ�У���μ���NaOH��Һ������ͼ���У�����ȷ��ʾ������Ӧ����(�������ʾ����NaOH��Һ��������������ʾ��Ӧ���ɳ���������) (����)
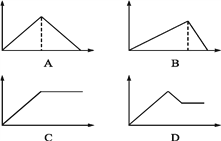
A. A B. B C. C D. D
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������۷ֱ�������4�ֵ��������Һ��ַ�Ӧ���ų����������ǣ� ��
A.3mol��L-1H2SO4��ҺB.18mol��L-1H2SO4��Һ
C.1.5 mol��L-1KOH��ҺD.3mol��L-1HNO3��Һ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���Ȼ���ֱ���������������ķ�Ӧ��4HCl(g)+O2(g)![]() 2Cl2(g)+2H2O(g)�����������У�����Ũ�ȱ�c(HCl)��c(O2)�ֱ����1��1��4��1��7��1ʱ��HClƽ��ת�������¶ȱ仯�Ĺ�ϵ��ͼ��ʾ������˵������ȷ���ǣ� ��
2Cl2(g)+2H2O(g)�����������У�����Ũ�ȱ�c(HCl)��c(O2)�ֱ����1��1��4��1��7��1ʱ��HClƽ��ת�������¶ȱ仯�Ĺ�ϵ��ͼ��ʾ������˵������ȷ���ǣ� ��
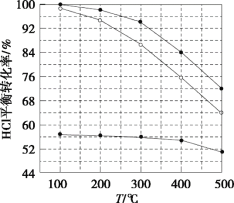
A.K(300��)>K(400��)
B.���ӷ�Ӧ��ѹǿ�ͼ�ʱ�������������������Ȼ����ת����
C.��c(HCl)��c(O2)���ϱȹ���ʱ��HCl��ת���ʽϵͣ��Ҳ����ڷ���O2��Cl2
D.��HCl�ij�ʼŨ��Ϊc�����ϱ�Ϊ1��1ʱ��K(500��)=![]()
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1��д�������л���Ľṹ��ʽ
3-������______ ��2��3��5-����-4-�һ�����______��
��2��ij����0.l mol��ȫȼ��ʱ����![]() ������������仯ѧʽ___����һ�ȴ����������칹�壬������������ƺͽṹ��ʽ�ֱ���____��____��
������������仯ѧʽ___����һ�ȴ����������칹�壬������������ƺͽṹ��ʽ�ֱ���____��____��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£�ij��ѧС��̽����������Һ�����ʡ�
װ�� | ʵ����� | ʵ����� | ʵ������ |
| ʵ��I | ���Թ��еμ�2%��ˮ�������� | �����غ�ɫ�����������μӳ�����ʧ |
ʵ��II | 1.���Թ��м���0.1mol��L-lNaOH��Һ1mL 2.�����μ�3%H2O2������ | 1.�����غ�ɫ���� 2.����������ɫ��ζ���壬�к�ɫ�������� | |
ʵ��III | 1.���Թ��еμ�1mL0.1molL-1KI��Һ 2.ȡ�����ϲ���Һ���Թܼ��У����������Һ | 1.������ɫ���� 2.��Һ�����Ա仯 |
��֪��AgOH��һ�ְ�ɫ���壬�����¼����ȶ����ֽ�Ϊ�غ�ɫ������ˮ������������
��1�������£�0.1mo1L-1AgNO3��ҺpHԼΪ4���������ӷ���ʽ����ԭ��___��
��2��ʵ��I�У���Ӧ�Ļ�ѧ����ʽ��___��
��3��ʵ��II�У������飬��ɫ�����ijɷ�ΪAg����Ag�����Ļ�ѧ����ʽ��___�����ⶨ��ʵ��������������ԶԶ���ڸ÷�Ӧ������ֵ�����ܵ�ԭ����___��
��4��ʵ���У�������ɫ���������ӷ���ʽ��___����ͬѧ���룬I-�л�ԭ�ԣ�Ag+�������ԣ�AgNO3��Һ��KI��ҺӦ�ÿ��Է���������ԭ��Ӧ�����������ͼԭ��أ���ʵ��IV֤���˲�����������У���A�ձ��У�ʯī�缫�����������������ֹ���������Ϊ�����ʡ�����Һ��___������B�ձ��в���IJ�����������___����������ԭ��Ӧ�����ӷ���ʽ��__��

��5���Ա�ʵ��III��ʵ��IV��ʵ��III��I2���ɵĿ���ԭ����___��д����������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵�����ʾ������ȷ����
A.�����ʵ������������������ֱ���ȫȼ�գ����߷ų�������
B.��C(ʯī��s)=C(���ʯ��s) ��H=+1.9kJ/mol��֪�����ʯ��ʯī�ȶ�
C.��101kPaʱ��2gH2��ȫȼ������Һ̬ˮ���ų�285.8kJ����������ȼ�յ��Ȼ�ѧ����ʽ��ʾΪ��2H2(g)+O2(g)=2H2O(l) ��H=��285.8kJ/mol
D.��ϡ��Һ�У�H+(aq)+OH��(aq)=H2O(l) ��H=��57.3kJ/mol��������0.5molH2SO4��Ũ�����뺬1molKOH����Һ��ϣ��ų�����������57.3kJ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������������壨FeSO4��7H2O����ҽҩ������Ѫ����ij����С��ⶨ�ò�Ѫ������Ԫ�صĺ�����������ò�Ѫ���Ƿ���ʡ�ʵ�鲽�����£�
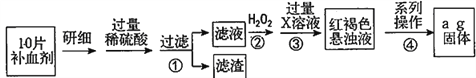
��ش��������⣺
��1��������ٵ���Һ�еμ�KSCN��Һ���Ϊ��ɫ�������Һ�к���______�������ӷ��ţ���
��2���������з�Ӧ�����ӷ���ʽ��__________________________________��
��3���������з�Ӧ�����ӷ���ʽ��__________________________________��
��4����������һϵ�д����IJ������裺���ˡ�______�����ա�_______��������
��5������ʵ���е���ĺ��Բ��ƣ���ÿƬ��Ѫ������Ԫ�ص�����Ϊ______g�����ú�a�Ĵ���ʽ��ʾ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������[NH4Fe(SO4)2��xH2O]��һ����Ҫ���Ρ�Ϊ���������Դ�����Ϊ������ʵ������̽�����÷���м���Ʊ�������泥������������£�

�ش��������⣺
��1������ٵ�Ŀ����ȥ������м��������ۣ�������_________________��
��2���������Ҫ���ȵ�Ŀ����_________________���¶ȱ���80~95 �棬���õĺ��ʼ��ȷ�ʽ��_________________����м�к������������Ӧ������������Ҫ�������������ʵ�װ��Ϊ_________________�����ţ���
��3���������ѡ��������H2O2��������_________________����������H2O2��ͬʱΪ��_________________����ҺҪ����pHС��0.5��
��4������ݵľ���ʵ�������______________��������õ�������茶�����Ʒ��
��5���������ط������ⶨ������茶�����Ʒ�����ᾧˮ��������Ʒ���ȵ�150 ��ʱ��ʧ��1.5���ᾧˮ��ʧ��5.6%��������茶���Ļ�ѧʽΪ______________��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com