
根据要求完成下列实验。(a、b 为弹簧夹,其他装置略去)
(一)验证酸性的相对强弱:碳酸>苯酚。(已知酸性:亚硫酸 >碳酸)
(1)铜与浓硫酸反应的化学方程式是_________________________________________,
装置A中的足量的试剂是 。
(2)连接仪器、 、加药品后,打开a关闭 b,然后滴入浓硫酸,加热。能说明碳酸的酸性比苯酚酸性强的实验现象是:____________________________。
(二)验证SO2具有氧化性、还原性和酸性氧化物的通性。
(3)打开b,关闭a。能验证SO2具有氧化性的化学方程式是_______________________。
(4)若过量的SO2通入NaOH溶液中,其化学方程式是:____________________________。
(5)BaCl2溶液中无任何现象,将其分成两份,分别滴加氨水和氯水,均产生白色沉淀,沉淀化学式分别是__________________,_________________。
(6)写出其中SO2显示还原性并生成白色沉淀的总的离子方程式___________________________________________________________。
(1) (2分)
(2分)
酸性高锰酸钾溶液或品红溶液(1分 合理给分)
(2)检验装置的气密性(1分)A中的酸性高锰酸钾溶液(或品红溶液)不褪色,苯酚钠溶液变浑浊。(1分)
(3)2H2S+SO2→3S↓+2H2O(2分)
(4)SO2+NaOH→NaHCO3(1分)
(5)BaSO3,BaSO4(2分)
(6)Ba2++SO2+Cl2+2H2O→BaSO4↓+4H++2Cl-(2分)
解析试题分析:(1)铜与浓硫酸反应的化学方程式是 ,装置A的作用是除去二氧化硫,防止干扰二氧化硫与苯酚钠的反应,可以利用强氧化性物质如:装置A中的足量的试剂是酸性高锰酸钾溶液或品红溶液。
,装置A的作用是除去二氧化硫,防止干扰二氧化硫与苯酚钠的反应,可以利用强氧化性物质如:装置A中的足量的试剂是酸性高锰酸钾溶液或品红溶液。
(2)装置A中反应制备气体,在加入药品之前需要检验装置的气密性。利用强酸制备弱酸,A中KMnO4溶液没有完全褪色,盛有苯酚钠溶液的试管中出现白色沉淀即可说明。
(3)要验证SO2具有氧化性化合价要降低,则发生2H2S+SO2=3S↓+2H2O这个反应。
(4)若过量的SO2通入NaOH溶液中,酸过量生成酸式盐,其化学方程式是:SO2+NaOH=NaHCO3。
(5)应后的BaCl2溶液中含有亚硫酸,亚硫酸被氯水氧化物硫酸,硫酸与氯化钡反应生成硫酸钡,亚硫酸与氨水反应生成亚硫酸铵,亚硫酸铵与氯化钡反应生成硫酸钡,故都产生白色沉淀,故答案为:两份溶液中均有白色沉淀生成;
(6)二氧化硫被氯水氧化为硫酸,反应中二氧化硫表现还原性,同时与氯化钡反应生成硫酸钡沉淀,故反应离子方程式为:Ba2++SO2+Cl2+2H2O=BaSO4↓+4H++2Cl-,故答案为:Ba2++SO2+Cl2+2H2O=BaSO4↓+4H++2Cl-。
考点:本题考查了实验方案的设计,涉及化学用语、物质性质、对装置的理解等,难度不大,理解实验原理是解题的关键,注意基础知识的理解掌握。


 学而优衔接教材南京大学出版社系列答案
学而优衔接教材南京大学出版社系列答案 小学课堂作业系列答案
小学课堂作业系列答案 金博士一点全通系列答案
金博士一点全通系列答案科目:高中化学 来源: 题型:实验题
为探究铜与稀硝酸反应产生的气体主要是NO,某课外活动小组设计了下列实验。图中D为止水夹,F是装有一半空气的注射器,其中加热装置和固定装置均已略去。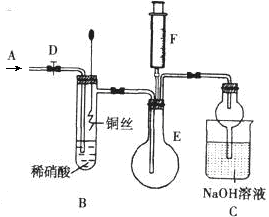
请回答有关问题:
(1)组装好装置后,关闭D,若装置的气密性良好,向外抽注射器活塞,C装置中有什么现象?
;
(2)反应开始前要向体系中通入气体A,为什么? ;A可以是 (填序号) ①N2 ②O2 ③空气 ④CO2
(3)当完成装置A的实验目的后,关闭D,再将装置B中的铜丝插入稀硝酸。B中反应的离子方程式是: 。
(4)反应一段时间后,将F中空气推入E中,证明生成了NO实验现象是: 。
(5)装置C的作用是: 。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
氨在人类的生产和生活中有着广泛的应用。某化学兴趣小组利用图一装置探究氨气的有
关性质。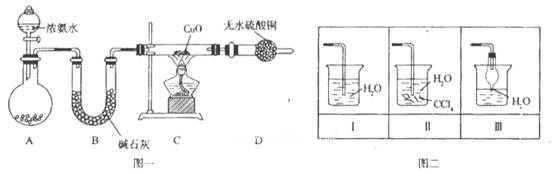
(1)装置A中烧瓶内试剂可选用__________(填序号)。B的作用是_______。
a.碱石灰 b.浓硫酸 C.生石灰 d.烧碱溶液
(2)连接好装置并检验装置的气密性后,装入药品,然后应先_______(填I或Ⅱ)。
I.打开旋塞逐滴向圆底烧瓶中加入氨水
Ⅱ.加热装置C
(3)实验中观察到C中CuO粉末变红,D中无水硫酸铜变蓝,并收集到一种单质气体,则该反应相关化学方程式为__________________________________________________。 该反应证明氨气具有_________ 性。
(4)该实验缺少尾气吸收装置,图二中能用来吸收尾气的装置是_________(填装置序号)。
(5)氨气极易溶于水,若标准状况下,将2.24 L的氨气溶于水配成0.5 L溶液,所得溶液的物质的量浓度为________________mol/L。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
二氧化硫是硫的重要化合物,在生产、生活中有广泛应用。探究二氧化硫的制取和性质都有着非常重要的意义。
(1)工业上用黄铁矿(FeS2,其中S元素为-1价)在高温下和氧气反应制备SO2:
该反应中被氧化的元素是__________(填元素符号)。当该反应转移5.50mol电子时,生成的二氧化硫在标准状况下的体积为________L。
(2)①实验室可用70%的浓硫酸和亚硫酸钠反应制取二氧化硫,如果能控制反应速度,下图中可选用的发生装置是_______(填写字母)。
②若用硫酸和亚硫酸钠反应制取3.36L(标准状况)二氧化硫,如果已有4.0%亚硫酸钠(质量分数)被氧化成硫酸钠,则至少需称取该亚硫酸钠_______g(保留一位小数)。
(3)某化学兴趣小组设计用如图装置验证二氧化硫的化学性质。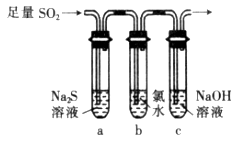
①能说明二氧化硫具有氧化性的实验现象为___________________________。
②为验证二氧化硫的还原性,充分反应后,取试管b中的溶液分成三份,分别进行如下实验:
方案Ⅰ:向第一份溶液加入品红溶液,红色褪去
方案Ⅱ:向第二份溶液加入BaCl2溶液,产生白色沉淀
方案Ⅲ:向第三份溶液中加入AgNO3溶液,有白色沉淀生成
上述方案中合理的是________(填“Ⅰ”、“Ⅱ”或“Ⅲ”);试管b中发生反应的离子方程式为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
某兴趣小组设计出下图所示装置来改进教材中“铜与硝酸反应”实验,以探究化学实验的绿色化。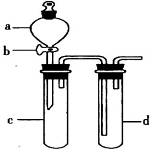
(1)实验前,关闭活塞b,试管d中加水至浸没长导管口,塞紧试管c和d的胶塞,加热c,其目的是________________________________。
(2)在d中加适量NaOH溶液,c中放一小块铜片,由分液漏斗a向c中加入2mL浓硝酸,c中反应的化学方程式是______________________________。再由a向c中加2mL蒸馏水,c中的实验现象是_______________________________。
(3)下表是制取硝酸铜的三种方案,能体现绿色化学理念的最佳方案是_____________,理由是_____________________________________。
(4)该小组同学向d中加入KBr溶液,c中加入固体KMnO4,由a向c中加入浓盐酸。观察到的实验现象是________________________;该小组同学实验目的是_________________,但此实验的不足之处是_____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
在实验室中用二氧化锰跟浓盐酸反应制备干燥纯净的氯气。所用仪器如图: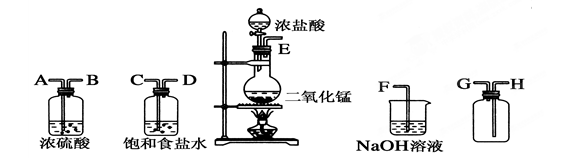
(1)连接上述仪器的正确顺序(填各接口处的字母):__接__;__接__;__接__;__接__。(2分)
(2)装置中,饱和食盐水的作用是______________;NaOH溶液的作用是____________。(4分)
(3)写出下列化学反应的方程式。
①气体发生装置中进行的反应:________________________________________。(2分)
②NaOH溶液中发生的反应:__________________________________________ 。(2分)
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
下图是实验室制取并收集Cl2的装置。A是Cl2发生装置,,E是硬质玻璃管中装有铜丝网;F为干燥的广口瓶,烧杯G为尾气吸收装置。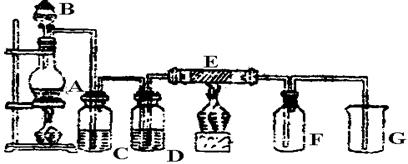
试回答:
(1)A中发生的化学反应的离子方程式为 。
(2)C、G中各装的药品:C__________;G__________。
(3)E反应方程式为 。
(4)写出G中反应的离子方程式 。
(5)若将Cl2和SO2等物质的量混合漂白作用减弱,用化学方程式解释原因 。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
某化学兴趣小组在实验室制取漂白粉,并探究氯气与石灰乳反应的条件和产物。
已知:①二氧化锰与浓盐酸反应可制备氯气,同时生成MnCl2。
②氯气和碱的反应的过程中放出热量。温度较高时,氯气和碱还能发生如下反应:6Cl2 + 6Ca(OH)2 5CaCl2 + Ca(ClO3)2 + 6H2O
5CaCl2 + Ca(ClO3)2 + 6H2O
该兴趣小组设计了下列实验装置,进行实验。
甲 乙 丙 丁
请回答下列问题:
(1)①甲装置中发生反应的化学方程式是 。
②乙装置中的试剂是 ,作用是 。
③该兴趣小组用300mL 12mol/L盐酸与17.4g MnO2制备氯气,并将所得氯气与过量的石灰乳反应。则理论上最多可制得标况下氯气 L,Ca(ClO)2 g。
(2)小组成员发现,产物中Ca(ClO)2的质量明显小于理论值。他们讨论后认为,部分氯气未与石灰乳反应而逸出,以及温度升高是可能原因。为了探究反应条件对产物的影响,他们另取一定量的石灰乳,缓慢、匀速地通入足量氯气,得出了ClO—、ClO3— 两种离子的物质的量(n)与反应时间(t)的关系曲线,粗略表示为下图(不考虑氯气和水的反应)。
①图中曲线Ⅱ表示 离子的物质的量随反应时间变化的关系。
②所取石灰乳中含有Ca(OH)2的物质的量为 mol。
③另取一份与②等物质的量Ca(OH)2的石灰乳,以较大的速率通入足量氯气,反应后测得产物中Cl—的物质的量为0.35mol,则产物中 = 。
= 。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
某校课外活动小组同学设计实验,探究木炭与浓硫酸在加热条件下反应生成气体的成分。
【实验探究】
(1)木炭与浓硫酸反应的化学方程式:C+2H2SO4(浓) CO2↑+2SO2↑+2H2O,其中浓H2 S04所起的作用是 (填“氧化剂”或“还原剂”)。若有0.2mol碳的完全反应,则消耗H2S04的质量是 g,标况下产生SO2的体积为______________L。
CO2↑+2SO2↑+2H2O,其中浓H2 S04所起的作用是 (填“氧化剂”或“还原剂”)。若有0.2mol碳的完全反应,则消耗H2S04的质量是 g,标况下产生SO2的体积为______________L。
(2)A装置中品红溶液颜色 (填“褪色”或“不褪色”),证明含有 气体。
(3)实验过程中,装置C将观察到的现象是_______________________________。
【实验讨论】
(4)有同学对B装置能否除尽SO2气体有疑义。你认为应该在B、C装置之间连接右图中 装置,以确认SO2是否除尽。
【联系实际】
(5)煤和石油的燃烧过程中都有二氧化硫和二氧化碳排放,其中二氧化硫造成的环境影响主要是_________,二氧化碳造成的环境影响主要是_______。(每空格只填一个选项)
A.酸雨 B.破坏臭氧层 C.温室效应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com