
��A��B��C��D��E���ֶ�����Ԫ�أ����ǵ�ԭ������������������B�ǵؿ��к�������Ԫ�أ���֪A��C��B��E�ֱ���ͬ����Ԫ�أ���B��E��Ԫ��ԭ�Ӻ���������֮����A��C��Ԫ��ԭ�Ӻ���������֮�͵�2��������ͬ���ڵ�C��D��EԪ���У�D�Ǹ����ڽ���Ԫ���н�����������Ԫ�أ�
��1���ԱȽ�C��D��Ԫ������������Ӧˮ������Ե�ǿ�����ѧʽ��
�� ��
��2��A��B��C�γɵĻ�����ľ�������Ϊ ������ʽΪ ��
��3�� д��D������CԪ������������Ӧˮ���ﷴӦ�����ӷ���ʽ ��
��4��д�����־���A��B��C��E����Ԫ�صĻ���������Һ�����Ӧ����������������ӷ���ʽ ��
��5��A���ʺ�B�����ܹ��ɵ�أ��õ���ö���Ե缫����ŨKOH��Һ�������ֱ�ͨ��A���ʺ�B���ʣ�д���õ�ظ����缫��Ӧ����ʽ ��
��6��ͨ�������£� C������������Ӧˮ����2mol��E����������Ӧˮ����1mol��ϡ��Һ�䷴Ӧ�ų�������Ϊ114.6KJ����д����ʾ�������仯�����ӷ���ʽ ��
 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����ɫ��ѧ���Ի�ѧ��Ӧ����ˡ�ԭ�Ӿ����ԡ�(ԭ�ӽ�Լ) �ĸ��Ҫ������ġ�ԭ�Ӿ����ԡ���Ӧ�У�ԭ�Ϸ����е�����ԭ��ȫ��ת��������������������ʵ�����ŷš����·�Ӧ�з��ϡ�ԭ�Ӿ����ԡ����� �� ��
A. �Ҵ�����������ȩ B.�Ҵ���Ũ���Ṳ������ϩ
C.����ϩ��һ���������ƾ۱���ϩ D.������������Ӧ��������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�������и�ʵ��װ��ͼ�������У���ȷ����(����)
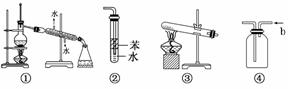
A��װ�âٿ����ڷ���е㲻ͬ�һ��ܵ�Һ������
B��װ�âڿ���������HCl���壬����ֹ����
C����NH4ClΪԭ�ϣ�װ�âۿ�����ʵ�����Ʊ�������NH3
D��װ�â��д�b�ڽ���������ˮ���ռ�NO2��CO������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��ͼΪ10 mLһ�����ʵ���Ũ�ȵ�����X����һ��Ũ�ȵ�NaOH��ҺY�ζ���ͼʾ������ͼʾ���Ƴ�X��Y�����ʵ���Ũ����(����)
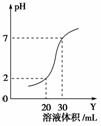
| A | B | C | D | |
| XŨ��/mol��L��1 | 0.12 | 0.04 | 0.03 | 0.09 |
| YŨ��/mol��L��1 | 0.04 | 0.12 | 0.09 | 0.03 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�������ӷ���ʽ��д��ȷ���ǣ��� ��
��A��̼�����ˮ�⣺HCO3��+H2O  H3O++CO32��
H3O++CO32��
��B������������Һ�м��������ˮ��Ag����NH3��H2O��AgOH����NH4��
��C��Ũ�Ⱦ�Ϊ0.1mol��L-1������������Һ��̼�������Һ��������
Ba2++2OH��+NH4++ HCO3��=BaCO3��+NH3��H2O+H2O
��D�������������Һ��ͨ������SO2���壺ClO����SO2��H2O��HClO��HSO3��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
���������У����ڷ����������ڱ���ͬϵ����ǣ� ��

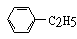
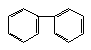 A B�� C �� D��CH3��
A B�� C �� D��CH3�� ��CH2Cl
��CH2Cl
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�л���A���������Ƿ��͵õ���Ҳ�ɴ���ţ������ȡ��������AΪ��ɫճ��Һ�壬������ˮ��Ϊ�о�A�������ṹ������������ʵ�飺
| ʵ �� �� �� | �� �� �� ʵ �� �� �� |
| ��1����ȡA 9.0g������ʹ�������������ܶ�����ͬ������H2��45���� | ��ͨ��������գ� ��1��A����Է�������Ϊ�� �� |
| ��2������9.0gA��������O2���ȼ�գ���ʹ��������λ���ͨ��Ũ���ᡢ��ʯ�ң��������߷ֱ�����5.4g��13.2g�� | ��2��A�ķ���ʽΪ�� �� |
| ��3����ȡA 9.0g����������NaHCO3��ĩ��Ӧ������2.24LCO2����״�������������������Ʒ�Ӧ������2.24LH2����״������ | ��3���ýṹ��ʽ��ʾA�к��еĹ����ţ�
�� |
| ��4��A�ĺ˴Ź�����������ͼ��
| ��4��A�к��� ����ԭ�ӡ� |
| ��5������������A�Ľṹ��ʽ �� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
ʢ���Ȼ���ϡ��Һ�ļס������Թֱܷ�ͨ��SO2�����ͣ�������Թ��м����������ᣬ���Թ��м�����������������Һ��������������ȷ����(����)
A���ס������Թܶ��а�ɫ��������
B���ס������Թܶ�û�а�ɫ��������
C�����Թ�û�а�ɫ�������ɶ����Թ���
D�����Թ��а�ɫ�������ɶ����Թ�û��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com