
【题目】铁片与稀硫酸反应制氢气,下列措施不能使氢气生成速率加大的是( )
A.加热B.用铁粉代替铁片
C.滴加适量CuSO4溶液D.用98%的浓硫酸代替稀硫酸
科目:高中化学 来源: 题型:
【题目】下列各步制取物质,最终无法达到目的的有( )
A. Al![]() Al2O3
Al2O3![]() AlCl3溶液
AlCl3溶液![]() Al2O3
Al2O3
B. Cu![]() CuO
CuO![]() CuSO4溶液
CuSO4溶液![]() CuSO4·5H2O
CuSO4·5H2O
C. Fe ![]() FeCl3
FeCl3 ![]() Fe(OH)3
Fe(OH)3 ![]() Fe2O3
Fe2O3
D. Al2(SO4)3溶液 ![]() Al(OH)3
Al(OH)3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室欲用NaOH固体配制1.0 mol/L的NaOH溶液240 mL;
(1)配制溶液时,一般可以分为以下几个步骤:
①称量 ②计算 ③溶解 ④摇匀 ⑤转移 ⑥洗涤 ⑦定容 ⑧冷却 ⑨摇动
其正确的操作顺序为_________。本实验必须用到的仪器有天平、药匙、玻璃棒、烧杯、________________。
(2)某同学欲称量NaOH的质量,他先用托盘天平称量烧杯的质量,天平平衡后的状态如下图所示。烧杯的实际质量为________g,要完成本实验该同学应称出________g NaOH。

(3)使用容量瓶前必须进行的一步操作是________。
(4)在配制过程中,其他操作都是正确的,下列操作会引起误差偏高的是________。
A.转移溶液时不慎有少量洒到容量瓶外面
B.定容时俯视刻度线
C.未冷却到室温就将溶液转移到容量瓶并定容
D.定容后塞上瓶塞反复摇匀,静置后,液面低于刻度线,再加水至刻度线
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】据报道,以NaBH4(B为+3价)和H2O2做原料的新型燃料电池可用作深水勘探等无空气环境下的电源,其结构如右图所示.该电池总反应式为:NaBH4+4H2O2=NaBO2+6H2O,下列的说法正确是( )

A. 放电过程中,Na+从右向左迁移
B. a为正极,其电极反应为:BH4--8e-+8OH-=BO2-+6H2O
C. b电极的电极反应式为:H2O2+2e-+2H+=2H2O
D. 每消耗300g、34%的H2O2溶液,理论上流过电路中的电子数为6NA个
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应的离子方程式中正确的是
A. 铜片插入硝酸银溶液中:Cu + Ag+ ![]() Cu2+ + Ag
Cu2+ + Ag
B. 在澄清石灰水中通入足量的CO2:Ca2++2OH-+CO2=CaCO3↓+H2O
C. 碳酸镁跟醋酸反应:MgCO3+2H+ ![]() Mg2+ +H2O+CO2↑
Mg2+ +H2O+CO2↑
D. 铁跟稀硫酸反应: Fe+2H+ ![]() Fe2+ + H2↑
Fe2+ + H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】盐在化学工业中有重要的应用,请回答下列问题:
(1)用化学方程式表示配制FeCl3溶液时常加入浓盐酸的原因______________________________________________
(2)常温下,在pH=3的Al2(SO4)3溶液与pH=11的Na2S溶液中,水电离出来的c(OH﹣)之比为______,将两溶液混合后,产生白色沉淀和有臭鸡蛋味的气体,其反应的离子方程式为_________________________
(3)c(NH4+)相等的下列溶液①NH4Cl ②NH4HSO4 ③(NH4)2SO4 ④CH3COONH4 ⑤NH3·H2O,溶液的物质的量浓度由小到大的顺序是______________________________________________________ (用序号表示)
(4)已知t℃时①AgCl的Ksp=2×10﹣10;②在t℃时,Ag2CrO4在水中的沉淀溶解平衡曲线如图所示.下列正确的是_______
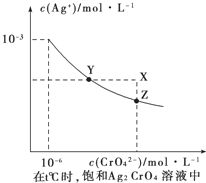
A.在饱和Ag2CrO4溶液中加入K2CrO4可使溶液由Y点到X点
B.在t℃时Ag2CrO4的Ksp为1×10-12
C.在t℃时反应:Ag2CrO4(s)+2Cl-(aq)![]() 2AgCl(s)+CrO42-(aq)的平衡常数为2.5×107
2AgCl(s)+CrO42-(aq)的平衡常数为2.5×107
D.在t℃时以0.01mol/L的AgNO3溶液滴定20mL浓度均为0.01mol/L的KCl和K2CrO4的混合溶液,CrO42-先沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由反应物 X 分别转化为 Y 和 Z 的能量变化如图所示。下列说法正确的是( )
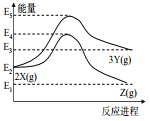
A.由 X→Z 反应的 ΔH<0 B.由 X→Y 反应的 ΔH=E5-E2
C.增大压强有利于提高 Y 的产率 D.升高温度有利于提高 Z 的产率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“低碳经济”备受关注,CO2的捕集、利用与封存成为科学家研究的重要课题。将一定量的CO2(B)和CH4(g)通入一恒容密闭容器中发生反应CO2(g)+CH4(g)![]() 2CO(g)+2H2(g)。回答下列问题:
2CO(g)+2H2(g)。回答下列问题:
(1)已知:CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H1=-802 kJ·mol-1
CO(g)+![]() O2(g)=CO2(g) △H2=-283kJ·mol-1
O2(g)=CO2(g) △H2=-283kJ·mol-1
CO(g)+H2O(g)=CO2(g)+H2(g) △H3=-41 kJ·mol-1
则反应CO2(g)+CH4(g)![]() 2CO(g) +2H2(g)的△H =___________。
2CO(g) +2H2(g)的△H =___________。
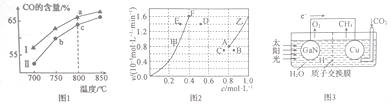
(2)其他条件相同,在不同催化剂(Ⅰ、Ⅱ)作用下,反应经过相同时间时,体系中CO含量随反应温度的变化如图1所示。
①在a点与c点对应的反应条件下,反应继续进行一段时间后达到平衡,平衡常数K(a 点)________K(c点 )( 填“>”“ <”或“=”)。
②b点CO含量低于c点的原因是____________________。
(3)为了探究反应:CO2(g) +CH4(g)![]() 2CO(g)+2H2(g)的反应速率与浓度的关系,起始时向恒容密闭容器中通入CO2与CH4,使其物质的量浓度均为1.0 mol·L-1,平衡时,根据相关数据绘制出两条反应速率与浓度关系曲线(如图2):v正~c(CH4)和v逆~c(CO)。则与曲线v正~c(CH4)相对应的是图中曲线____________(填“甲”或“乙”);该反应达到平衡后,某一时刻降低温度,反应重新达到平衡,则此时曲线甲对应的平衡点可能为____________(填字母)。
2CO(g)+2H2(g)的反应速率与浓度的关系,起始时向恒容密闭容器中通入CO2与CH4,使其物质的量浓度均为1.0 mol·L-1,平衡时,根据相关数据绘制出两条反应速率与浓度关系曲线(如图2):v正~c(CH4)和v逆~c(CO)。则与曲线v正~c(CH4)相对应的是图中曲线____________(填“甲”或“乙”);该反应达到平衡后,某一时刻降低温度,反应重新达到平衡,则此时曲线甲对应的平衡点可能为____________(填字母)。
(4)将足量CO2通入饱和氨水中可得氮肥NH4HCO3。在NH4HCO3溶液中,反应NH4++HCO3-+H2O![]() NH3·H2O+H2CO3的平衡常数K=_________(已知常温下NH3·H2O的电离平衡常数Kb=2×10-5,H2CO3的电离平衡常数Ka2=4×10-11)。
NH3·H2O+H2CO3的平衡常数K=_________(已知常温下NH3·H2O的电离平衡常数Kb=2×10-5,H2CO3的电离平衡常数Ka2=4×10-11)。
(5)科学家用氮化镓材料与铜组装成如图3所示的人工光合系统,利用该装置成功地实现了用CO2和H2O合成CH4。。氮化镓(GaN)表面发生__________(填“氧化”或“还 原”)反应,铜电极上的电极反应式为______________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com