
【题目】盐在化学工业中有重要的应用,请回答下列问题:
(1)用化学方程式表示配制FeCl3溶液时常加入浓盐酸的原因______________________________________________
(2)常温下,在pH=3的Al2(SO4)3溶液与pH=11的Na2S溶液中,水电离出来的c(OH﹣)之比为______,将两溶液混合后,产生白色沉淀和有臭鸡蛋味的气体,其反应的离子方程式为_________________________
(3)c(NH4+)相等的下列溶液①NH4Cl ②NH4HSO4 ③(NH4)2SO4 ④CH3COONH4 ⑤NH3·H2O,溶液的物质的量浓度由小到大的顺序是______________________________________________________ (用序号表示)
(4)已知t℃时①AgCl的Ksp=2×10﹣10;②在t℃时,Ag2CrO4在水中的沉淀溶解平衡曲线如图所示.下列正确的是_______
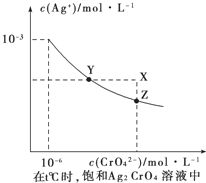
A.在饱和Ag2CrO4溶液中加入K2CrO4可使溶液由Y点到X点
B.在t℃时Ag2CrO4的Ksp为1×10-12
C.在t℃时反应:Ag2CrO4(s)+2Cl-(aq)![]() 2AgCl(s)+CrO42-(aq)的平衡常数为2.5×107
2AgCl(s)+CrO42-(aq)的平衡常数为2.5×107
D.在t℃时以0.01mol/L的AgNO3溶液滴定20mL浓度均为0.01mol/L的KCl和K2CrO4的混合溶液,CrO42-先沉淀
【答案】 FeCl3+3H2O![]() Fe(OH)3+3HCl 1:1 2Al3++3S2-+6H2O==2Al(OH)3↓+3H2S↑ ③<②<①<④<⑤ BC
Fe(OH)3+3HCl 1:1 2Al3++3S2-+6H2O==2Al(OH)3↓+3H2S↑ ③<②<①<④<⑤ BC
【解析】试题分析:本题考查盐的水解,盐溶液中水电离的c(OH-)的计算,双水解离子方程式的书写,溶液中粒子浓度大小比较,沉淀溶解平衡曲线的分析。
(1)FeCl3属于强酸弱碱盐,在FeCl3溶液中存在水解平衡:FeCl3+3H2O![]() Fe(OH)3+3HCl,加入浓盐酸,水解平衡向逆反应方向移动,抑制FeCl3的水解,避免出现浑浊。
Fe(OH)3+3HCl,加入浓盐酸,水解平衡向逆反应方向移动,抑制FeCl3的水解,避免出现浑浊。
(2)Al2(SO4)3属于强酸弱碱盐,由于Al3+的水解使溶液呈酸性,pH=3的Al2(SO4)3溶液中c(H+)=1![]() 10-3mol/L,c(OH-)水=c(H+)水=c(H+)溶液=1
10-3mol/L,c(OH-)水=c(H+)水=c(H+)溶液=1![]() 10-3mol/L;Na2S属于强碱弱酸盐,由于S2-的水解使溶液呈碱性,pH=11的Na2S溶液中c(H+)=1
10-3mol/L;Na2S属于强碱弱酸盐,由于S2-的水解使溶液呈碱性,pH=11的Na2S溶液中c(H+)=1![]() 10-11mol/L,常温下c(OH-)=1
10-11mol/L,常温下c(OH-)=1![]() 10-3mol/L,c(OH-)水=c(OH-)溶液=1
10-3mol/L,c(OH-)水=c(OH-)溶液=1![]() 10-3mol/L;两溶液中水电离出来的c(OH-)之比为1:1。Al2(SO4)3溶液和Na2S溶液混合发生双水解反应生成Al(OH)3白色沉淀和臭鸡蛋气味的H2S气体,反应的离子方程式为2Al3++3S2-+6H2O=2Al(OH)3↓+3H2S↑。
10-3mol/L;两溶液中水电离出来的c(OH-)之比为1:1。Al2(SO4)3溶液和Na2S溶液混合发生双水解反应生成Al(OH)3白色沉淀和臭鸡蛋气味的H2S气体,反应的离子方程式为2Al3++3S2-+6H2O=2Al(OH)3↓+3H2S↑。
(3)1molNH4Cl、NH4HSO4、CH3COONH4完全电离产生1molNH4+,1mol(NH4)2SO4完全电离产生2molNH4+,NH3·H2O部分电离产生NH4+,则c(NH4+)相等的溶液中,NH3·H2O(⑤)物质的量浓度最大,(NH4)2SO4溶液(③)物质的量浓度最小;在NH4HSO4溶液中NH4HSO4电离出的H+对NH4+的水解起抑制作用,在CH3COONH4溶液中CH3COO-的水解对NH4+的水解起促进作用,则c(NH4+)相等的溶液中,物质的量浓度:c(CH3COONH4)![]() c(NH4Cl)
c(NH4Cl)![]() c(NH4HSO4;c(NH4+)相等的溶液中,物质的量浓度由小到大的顺序为③
c(NH4HSO4;c(NH4+)相等的溶液中,物质的量浓度由小到大的顺序为③![]() ②
②![]() ①
①![]() ④
④![]() ⑤。
⑤。
(4)A,在Ag2CrO4饱和溶液中存在溶解平衡:Ag2CrO4(s)![]() 2Ag+(aq)+CrO42-(aq),加入K2CrO4,CrO42-浓度增大,平衡逆向移动,Ag+浓度减小,A项错误;B,由图可见当c(CrO42-)=10-6mol/L时,c(Ag+)=10-3mol/L,Ksp(Ag2CrO4)=c2(Ag+)·c(CrO42-)=(10-3)2
2Ag+(aq)+CrO42-(aq),加入K2CrO4,CrO42-浓度增大,平衡逆向移动,Ag+浓度减小,A项错误;B,由图可见当c(CrO42-)=10-6mol/L时,c(Ag+)=10-3mol/L,Ksp(Ag2CrO4)=c2(Ag+)·c(CrO42-)=(10-3)2![]() 10-6=10-12,B项正确;C,反应Ag2CrO4(s)+2Cl-(aq)
10-6=10-12,B项正确;C,反应Ag2CrO4(s)+2Cl-(aq)![]() 2AgCl(s)+CrO42-(aq)的平衡常数=
2AgCl(s)+CrO42-(aq)的平衡常数=![]() =
=![]() =
=![]() =
=![]() =2.5
=2.5![]() 107,C项正确;D,Cl-开始沉淀时c(Ag+)=
107,C项正确;D,Cl-开始沉淀时c(Ag+)=![]() =2
=2![]() 10-8mol/L,CrO42-开始沉淀时c(Ag+)=
10-8mol/L,CrO42-开始沉淀时c(Ag+)=![]() =1
=1![]() 10-5mol/L
10-5mol/L![]() 2
2![]() 10-8mol/L,Cl-先沉淀,D项错误;答案选BC。
10-8mol/L,Cl-先沉淀,D项错误;答案选BC。


科目:高中化学 来源: 题型:
【题目】氯化铁是一种重要的化学试剂,其晶体的化学式为FeCl3·6H2O。FeCl3的饱和溶液在实验室和电子工业中都有重要应用。
(1)饱和FeCl3溶液的颜色是______________色的,实验室里常用它来制备______________(化学式)胶体,具体操作方法是:先将烧杯中的水加热至沸腾,再滴入5~6滴____________________,______________至液体呈______________色,停止加热。
(2)电子工业中 ,常用FeCl3的饱和溶液来印刷电路图板,反应的原理是:Cu+2FeCl3=2FeCl2+CuCl2。该反应中______________作氧化剂,用单线桥法表示电子转移的方向和数目:____________。
(3)将0.5mol·L—1的FeCl3溶液从100mL稀释至500mL,所得溶液中,c(Cl—)为__________。(写出计算过程)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁片与稀硫酸反应制氢气,下列措施不能使氢气生成速率加大的是( )
A.加热B.用铁粉代替铁片
C.滴加适量CuSO4溶液D.用98%的浓硫酸代替稀硫酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. π键是由两个p电子以“头碰头”方式重叠而成
B. σ键是镜面对称,而π键是轴对称
C. 乙烷分子中的键全为σ键而乙烯分子中含σ键和π键
D. H2分子中含σ键,Cl2分子中含π键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在标准状况下,下列气体中含有氢原子质量最大的是
A. 0.5mol HCl B. 6.4g CH4 C. 6.72L NH3 D. 1.204![]() 1023个H2S
1023个H2S
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A. 基态氧原子与基态氮原子中未成对电子数之比是2∶3
B. 基态氮原子与基态磷原子中未成对电子数之比是1∶1
C. 基态碳原子与基态氮原子中未成对电子数之比是3∶4
D. 基态铜原子中未成对电子数是1
查看答案和解析>>
科目:高中化学 来源: 题型:
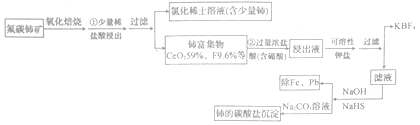
【题目】稀土是一种重要的战略资源、氟碳铈矿主要化学成分为CeFCO3,它是提取铈等稀土元素的重要矿物原料。氟碳铈矿的冶炼工艺流程如下:
已知:Ⅰ.铈的常见化合价为+3、+4
Ⅱ.Ce4+可以与SO42-结合为[CeSO4]2+
Ⅲ. 
焙烧时铈被氧化成四价,四价铈不易进入溶液,而三价稀土元素易进入溶液。在盐酸浸出时,有少量铈进入滤液,且产生黄绿色气体。
回答下列问题:
(1)氟碳铈矿焙烧的目的是__________________;焙烧最适宜温度为______________(填标号)。a.350~450℃ b.550~650℃ C.750℃以上
步骤①中少量铈进入稀土溶液发生反应的离子方程式是_________________________。
(2)铈富集物用含硼酸的盐酸溶液处理,使氟转化为四氟硼酸根离子,然后用可溶性钾盐将四氟硼酸根离子转变为KBF4沉淀并过滤除去。写出生成KBF4的离子方程式:________________。此法处理铈富集物的缺点是____________________。
(3)除云氟离子后向滤液中先加入NaOH溶液,然后再加入NaHS除去铁与铅。加入NaOH溶液的目的是____________________。
(4)写出此流程中铈的碳酸盐沉淀的化学式:______________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com