
����Ŀ���Ȼ�����һ����Ҫ�Ļ�ѧ�Լ����侧��Ļ�ѧʽΪFeCl3��6H2O��FeCl3�ı�����Һ��ʵ���Һ͵��ӹ�ҵ�ж�����ҪӦ�á�
��1������FeCl3��Һ����ɫ��______________ɫ�ģ�ʵ�����ﳣ�������Ʊ�______________����ѧʽ�����壬������������ǣ��Ƚ��ձ��е�ˮ���������ڣ��ٵ���5~6��____________________��______________��Һ���______________ɫ��ֹͣ���ȡ�
��2�����ӹ�ҵ�� ������FeCl3�ı�����Һ��ӡˢ��·ͼ�壬��Ӧ��ԭ���ǣ�Cu+2FeCl3=2FeCl2+CuCl2���÷�Ӧ��______________�����������õ����ŷ���ʾ����ת�Ƶķ������Ŀ��____________��
��3����0.5mol��L��1��FeCl3��Һ��100mLϡ����500mL��������Һ�У�c(Cl����Ϊ__________����д��������̣�
���𰸡��ػ� Fe(OH)3 FeCl3�ı�����Һ ������� ��� FeCl3 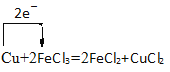 0.3mol��L��1
0.3mol��L��1
��������
��1��������������������Ʊ����̺��������ش�
��2���õ��ӻ��ϼ۽��͵ķ�Ӧ��������������Ӧ��ͭʧȥ2mol���ӣ�2mol�����ӵ�2mol���ӣ��ɴ˻�����������
��3������ϡ�Ͷ��ɽ⣻
��1������FeCl3��Һ����ɫ�ǻ�ɫ�ģ�ʵ�����ﳣ�������Ʊ� Fe(OH)3����ѧʽ�����壬������������ǣ��Ƚ��ձ��е�ˮ���������ڣ��ٵ���5~6��FeCl3�ı�����Һ�����������Һ��ʺ��ɫ��ֹͣ���ȡ�
��2�����ӹ�ҵ�� ������FeCl3�ı�����Һ��ӡˢ��·ͼ�壬��Ӧ��ԭ���ǣ�Cu+2FeCl3=2FeCl2+CuCl2���÷�Ӧ�еõ��ӻ��ϼ۽��͵ķ�Ӧ������������FeCl3�����������õ����ŷ���ʾ����ת�Ƶķ������Ŀ��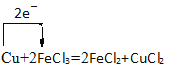 ��
��
��3����0.5mol��L��1��FeCl3��Һ��100mLϡ����500mL��������Һ�У�c(Cl����Ϊ_
c(Cl����=0.5mol��L��1��3��0.1L/0.5L= 0.3mol��L��1��


 ѧ�ڸ�ϰһ��ͨѧϰ�ܶ�Ա��ĩ������ӱ����������ϵ�д�
ѧ�ڸ�ϰһ��ͨѧϰ�ܶ�Ա��ĩ������ӱ����������ϵ�д� â���̸����������������ϵ�д�
â���̸����������������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и���Ӧ�����ڼӳɷ�Ӧ����
A.CH4+2O2��CO2+2H2OB.CH2=CH2+H-OH��CH3-CH2OH
C.CH4+Cl2��CH3Cl+HClD.HCl+AgNO3=AgCl��+HNO3
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и���Ԫ���У���������۵���˳�����е��ǣ� ��
A.C��N��O��F
B.Li��Na��K��Rb
C.F��Cl��Br��I
D.K��Mg��C��S
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��п���仯������;�㷺���ش���������
��1������п����п��(��Ҫ�ɷ���ZnS) Ϊ��Ҫԭ�ϣ��漰����Ҫ��Ӧ�У�
2ZnS(s)+3O2(g)=2ZnO(s)+2SO2(g) ��H1=-930kJ��mol-1
C(s)+O2(g)=CO2(g) ��H2=-393.5 kJ��mol-1
C(s)+CO2(g)=2CO(g) ��H3= +172.5 kJ��mol-1
ZnO(s)+CO(g)=Zn(g)+CO2(g)��H4= +198 kJ��mol-1
��ӦZnS(s)+tC(s)+2O2(g)=Zn(g)+CO2(g)+SO2(g)�ġ�H =_________kJ��mol-1
��2����п���ع���ԭ��ΪAg2O2+2Zn+2H2O![]() 2Ag +2Zn(OH)2,�����س��ʱ��������ԭ��Ӧ��������__________�� ������Ӧ��Ϊ�����Σ��ڶ���ΪAg2O+H2O+2e-= 2Ag+2OH-,д ����һ�� �� ���� �缫��Ӧʽ_____________________________��
2Ag +2Zn(OH)2,�����س��ʱ��������ԭ��Ӧ��������__________�� ������Ӧ��Ϊ�����Σ��ڶ���ΪAg2O+H2O+2e-= 2Ag+2OH-,д ����һ�� �� ���� �缫��Ӧʽ_____________________________��
��3���ԣ�2������������Դ������ͼ��ʾ��װ����ʵ����ģ������Ʒ���桰�ۻ��������Ĺ����У�������Һ�����,ԭ����__________________(����صĵ缫��Ӧʽ�����ӷ���ʽ��ʾ)��
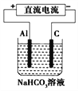
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ʵ������ܴﵽĿ�ĵ��ǣ� ��
A.�ü�ʯ�Ҹ�������
B.��Ʒ����Һ����CO2��SO2
C.���Ҵ���ȡ��ˮ�еĵⵥ��
D.�ó���ʯ��ˮ����̼������Һ���Ƿ���̼������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����BaCl2��NaCl�Ļ����ҺVL�������ֳ����ȷݡ�һ�ݵμ�ϡ���ᣬʹBa2+��ȫ��������һ�ݵμ�AgNO3��Һ��ʹCl-��ȫ��������Ӧ������amolH2SO4��bmolAgNO3����ԭ�����Һ�е�c(Na+)Ϊ
A. ![]() mol/L B.
mol/L B. ![]() mol/L C.
mol/L C. ![]() mol/L D.
mol/L D. ![]() mol/L
mol/L
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и�����ȡ�������������ﵽĿ�ĵ���(����)
A. Al![]() Al2O3
Al2O3![]() AlCl3��Һ
AlCl3��Һ![]() Al2O3
Al2O3
B. Cu![]() CuO
CuO![]() CuSO4��Һ
CuSO4��Һ![]() CuSO4��5H2O
CuSO4��5H2O
C. Fe ![]() FeCl3
FeCl3 ![]() Fe(OH)3
Fe(OH)3 ![]() Fe2O3
Fe2O3
D. Al2(SO4)3��Һ ![]() Al(OH)3
Al(OH)3
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ڻ�ѧ��ҵ������Ҫ��Ӧ�ã���ش��������⣺
��1���û�ѧ����ʽ��ʾ����FeCl3��Һʱ������Ũ�����ԭ��______________________________________________
��2�������£���pH=3��Al2(SO4)3��Һ��pH=11��Na2S��Һ�У�ˮ���������c(OH��)֮��Ϊ______��������Һ��Ϻ�����ɫ�������г�����ζ�����壬�䷴Ӧ�����ӷ���ʽΪ_________________________
��3��c(NH4+)��ȵ�������Һ��NH4Cl ��NH4HSO4 ��(NH4)2SO4 ��CH3COONH4 ��NH3��H2O����Һ�����ʵ���Ũ����С�����˳����______________________________________________________ (����ű�ʾ)
��4����֪t��ʱ��AgCl��Ksp=2��10��10������t��ʱ��Ag2CrO4��ˮ�еij����ܽ�ƽ��������ͼ��ʾ��������ȷ����_______
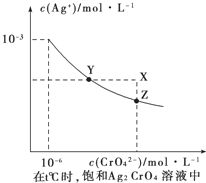
A.�ڱ���Ag2CrO4��Һ�м���K2CrO4��ʹ��Һ��Y�㵽X��
B.��t��ʱAg2CrO4��KspΪ1��10-12
C.��t��ʱ��Ӧ:Ag2CrO4(s)��2Cl-(aq)![]() 2AgCl(s)��CrO42-(aq)��ƽ�ⳣ��Ϊ2.5��107
2AgCl(s)��CrO42-(aq)��ƽ�ⳣ��Ϊ2.5��107
D.��t��ʱ��0.01mol/L��AgNO3��Һ�ζ�20mLŨ�Ⱦ�Ϊ0.01mol/L��KCl��K2CrO4�Ļ����Һ��CrO42-�ȳ���
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com