
【题目】锌及其化合物用途广泛。回答下列问题
(1)火法炼锌以闪锌矿(主要成分是ZnS) 为主要原料,涉及的主要反应有:
2ZnS(s)+3O2(g)=2ZnO(s)+2SO2(g) △H1=-930kJ·mol-1
C(s)+O2(g)=CO2(g) △H2=-393.5 kJ·mol-1
C(s)+CO2(g)=2CO(g) △H3= +172.5 kJ·mol-1
ZnO(s)+CO(g)=Zn(g)+CO2(g)△H4= +198 kJ·mol-1
反应ZnS(s)+tC(s)+2O2(g)=Zn(g)+CO2(g)+SO2(g)的△H =_________kJ·mol-1
(2)银锌蓄电池工作原理为Ag2O2+2Zn+2H2O![]() 2Ag +2Zn(OH)2,该蓄电池充电时,发生还原反应的物质是__________, 正极反应分为两个阶段,第二阶段为Ag2O+H2O+2e-= 2Ag+2OH-,写 出第一阶 段 正极 电极反应式_____________________________。
2Ag +2Zn(OH)2,该蓄电池充电时,发生还原反应的物质是__________, 正极反应分为两个阶段,第二阶段为Ag2O+H2O+2e-= 2Ag+2OH-,写 出第一阶 段 正极 电极反应式_____________________________。
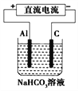
(3)以(2)中蓄电池作电源,用如图所示的装置在实验室模拟铝制品表面“钝化”处理的过程中,发现溶液逐渐变浑浊,原因是__________________(用相关的电极反应式和离子方程式表示)。
【答案】 -377.5 Zn(OH)2 Ag2O2+H2O+2e-=Ag2O+2OH- Al-3e-=Al3+,Al3++3HCO3-=Al(OH)3↓+3CO2↑或Al-3e-+3HCO3-=Al(OH)3↓+3CO2↑
【解析】(1)①2ZnS(s)+3O2(g)═2ZnO(s)+2SO2(g)△H1=-930kJmol-1,②2C(s)+O2(g)═2CO(g)△H2=-221kJmol-1,③ZnO(s)+CO(g)═Zn(g)+CO2(g)△H3=198kJmol-1,根据盖斯定律,将方程式![]() +③得ZnS(s)+C(s)+2O2(g)═Zn(g)+CO2(g)+SO2(g),△H4=
+③得ZnS(s)+C(s)+2O2(g)═Zn(g)+CO2(g)+SO2(g),△H4=![]() +198kJ/mol=-377.5kJ/mol,故答案为:-377.5;
+198kJ/mol=-377.5kJ/mol,故答案为:-377.5;
(2)银锌蓄电池工作原理为Ag2O2+2Zn+2H2O![]() 2Ag+2Zn(OH)2,该蓄电池充电时,阴极发生还原反应,根据方程式,阴极上发生还原反应的物质为Zn(OH)2;放电时是原电池,正极发生还原反应,反应分为两个阶段,第二阶段为Ag2O+H2O+2e-=2Ag+2OH-,则第一阶段正极的电极反应式为Ag2O2+H2O+2e-=Ag2O+2OH-,故答案为:Zn(OH)2;Ag2O2+H2O+2e-=Ag2O+2OH-;
2Ag+2Zn(OH)2,该蓄电池充电时,阴极发生还原反应,根据方程式,阴极上发生还原反应的物质为Zn(OH)2;放电时是原电池,正极发生还原反应,反应分为两个阶段,第二阶段为Ag2O+H2O+2e-=2Ag+2OH-,则第一阶段正极的电极反应式为Ag2O2+H2O+2e-=Ag2O+2OH-,故答案为:Zn(OH)2;Ag2O2+H2O+2e-=Ag2O+2OH-;
(3)铝作阳极,阳极上电极反应式为Al=Al3++3e-;阳极上生成的铝离子和碳酸氢根离子发生双水解反应生成氢氧化铝沉淀和二氧化碳气体,所以溶液变浑浊Al3++3HCO3-=Al(OH)3↓+3CO2↑,故答案为:Al=Al3++3e-、Al3++3HCO3-=Al(OH)3↓+3CO2↑。


科目:高中化学 来源: 题型:
【题目】在一定条件下的密闭容器中发生反应:C(s)+CO2(g)=2CO(g).下列说法不正确的是( )
A.将碳块磨成粉末可加快反应速率
B.增加碳的质量可加快反应速率
C.升高温度可加快反应速率
D.容器体积不变时,向容器中充入氦气,反应速率不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于放热反应A+B=C+D,以下说法正确的是(EA、EB、EC、ED分别代表A、B、C、D所具有的能量)( )
A.EA>EB
B.EA>EC+ED
C.EA+EB>EC+ED
D.EA+EB<EC+ED
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】环氧氯丙烷是制备环氧树脂的主要原料,工业上有不同的合成路线,以下是其中的一种(有些反应未注明条件)。
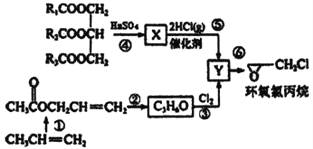
完成下列填空:
(1)X的结构简式_________Y中的不含氧官能团的名称为____________________
(2)反应①中的合成原料还有O2和醋酸及催化剂,写出该反应的化学方程式______________________。
(3)下列说法不正确的是__________
A.如R1、R2、R3不完全相同,则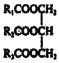 是混合物
是混合物
B.Y的结构简式是不能确定的,可能有两种不同的结构
C.反应②④⑤⑥都是取代反应
D.X与乙醇不是同系物,两者都能使酸性KMnO4溶液褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】不同浓度的硫酸与锌反应时,硫酸可以被还原为SO2,也可被还原为氢气。某校研究性学习小组拟设计下列实验验证这一事实。

(1)该小组设计了如上图所示的实验装置,检查该装置气密性的操作是______________________。
(2)若1.30g锌粒完全溶解,氢氧化钠洗气瓶增重0.64g(烧瓶中残留气体忽略不计,下同),则圆底烧瓶中发生反应的化学方程式为________________________________。
(3)是否使用橡胶管,对实验结果___________(填“有”或“无”) 影响。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化铁是一种重要的化学试剂,其晶体的化学式为FeCl3·6H2O。FeCl3的饱和溶液在实验室和电子工业中都有重要应用。
(1)饱和FeCl3溶液的颜色是______________色的,实验室里常用它来制备______________(化学式)胶体,具体操作方法是:先将烧杯中的水加热至沸腾,再滴入5~6滴____________________,______________至液体呈______________色,停止加热。
(2)电子工业中 ,常用FeCl3的饱和溶液来印刷电路图板,反应的原理是:Cu+2FeCl3=2FeCl2+CuCl2。该反应中______________作氧化剂,用单线桥法表示电子转移的方向和数目:____________。
(3)将0.5mol·L—1的FeCl3溶液从100mL稀释至500mL,所得溶液中,c(Cl—)为__________。(写出计算过程)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏伽德罗常数的值。下列有关叙述正确的是( )
A. 24g镁在足量的O2中燃烧,转移的电子数为0.1NA
B. 分子总数为NA的NO2和CO2混合气体中含有的氧原子數为2NA
C. 1L一氧化碳气体一定比1L氧气的质量小
D. 常温常压下8gO3中含有8NA个电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请用C、H、O、N、S五种元素回答下列问题
(1)除H外,其它四种元素中,第一电离能最大的元素基态原子电子排布图为______________,电负性最大的元素基态原子核外电子运动状态共有_________种。
(2)五种元素中,由其中两种元素构成甲、乙、丙、丁四种分子,所含原子的数目依次为3、4、6、8,都含有18个电子。甲和乙的主要物理性质比较如下:
熔点/K | 沸点/K | 标准状况时在水中的溶解度 | |
甲 | 187 | 202 | 2.6 |
乙 | 272 | 423 | 以任意比互溶 |
①1mol乙分子含有_________个σ键;
②丁分子的中心原子采取_________杂化方式;甲分子的VSEPR模型为_________,丙分子为_________(“极性”或“非极性”)分子。
③甲和乙的相对分子质量基本相同,造成上述物理性质差异的主要原因是:____________________(结合具体物质解释)。
(3)已知
化学键 | N-N | N=N | N | C-C | C=C | C |
键能/kJ·mol-1 | 193 | 418 | 946 | 347.7 | 615 | 812 |
由以上数据可知,氮气比乙烯、乙炔难发生加成反应,原因是____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. π键是由两个p电子以“头碰头”方式重叠而成
B. σ键是镜面对称,而π键是轴对称
C. 乙烷分子中的键全为σ键而乙烯分子中含σ键和π键
D. H2分子中含σ键,Cl2分子中含π键
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com