
【题目】环氧氯丙烷是制备环氧树脂的主要原料,工业上有不同的合成路线,以下是其中的一种(有些反应未注明条件)。
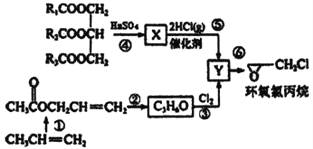
完成下列填空:
(1)X的结构简式_________Y中的不含氧官能团的名称为____________________
(2)反应①中的合成原料还有O2和醋酸及催化剂,写出该反应的化学方程式______________________。
(3)下列说法不正确的是__________
A.如R1、R2、R3不完全相同,则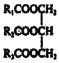 是混合物
是混合物
B.Y的结构简式是不能确定的,可能有两种不同的结构
C.反应②④⑤⑥都是取代反应
D.X与乙醇不是同系物,两者都能使酸性KMnO4溶液褪色
【答案】 ![]() 氯原子 2CH3CH=CH2+2CH3COOH+O2
氯原子 2CH3CH=CH2+2CH3COOH+O2![]() 2CH2=CHCHOOCCH3+2H2O AB
2CH2=CHCHOOCCH3+2H2O AB
【解析】(1)根据流程图,Y为![]() ,则X为
,则X为![]() ,Y中的不含氧官能团为氯原子,故答案为:
,Y中的不含氧官能团为氯原子,故答案为:![]() ;氯原子;
;氯原子;
(2)根据流程图,反应①中的合成原料还有O2和醋酸及催化剂,反应的化学方程式2CH3CH=CH2+2CH3COOH+O2![]() 2CH2=CHCHOOCCH3+2H2O,故答案为:2CH3CH=CH2+2CH3COOH+O2
2CH2=CHCHOOCCH3+2H2O,故答案为:2CH3CH=CH2+2CH3COOH+O2![]() 2CH2=CHCHOOCCH3+2H2O;
2CH2=CHCHOOCCH3+2H2O;
(3)A.如R1、R2、R3不完全相同,则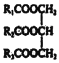 属于混甘油酯,但仍为纯净物,错误;B.根据环氧氯丙烷的结构可知,Y为
属于混甘油酯,但仍为纯净物,错误;B.根据环氧氯丙烷的结构可知,Y为![]() ,错误;C.根据反应②生成物的化学式可知,反应②为酯的水解反应;根据X的结构可知,反应④为油脂的水解反应;反应⑤为甘油与氯化氢的取代反应;反应⑥是羟基间的脱水反应,属于取代反应,都是取代反应,正确;D.X(
,错误;C.根据反应②生成物的化学式可知,反应②为酯的水解反应;根据X的结构可知,反应④为油脂的水解反应;反应⑤为甘油与氯化氢的取代反应;反应⑥是羟基间的脱水反应,属于取代反应,都是取代反应,正确;D.X(![]() )中含有3个羟基,与乙醇不是同系物,羟基能使酸性KMnO4溶液褪色,正确;故选AB。
)中含有3个羟基,与乙醇不是同系物,羟基能使酸性KMnO4溶液褪色,正确;故选AB。


 中考解读考点精练系列答案
中考解读考点精练系列答案科目:高中化学 来源: 题型:
【题目】Ⅰ、目前已开发出用电解法制取ClO2的新工艺。
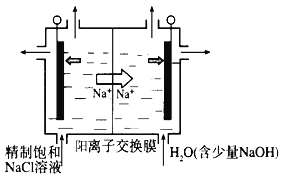
(1)图中用石墨做电极,在一定条件下电解饱和食盐水制取ClO2。则阳极产生ClO2的电极反应式为___________________________________________。
(2)电解一段时间,当阴极产生的气体体积为112 mL(标准状况)时,停止电解。通过阳离子交换膜的阳离子的物质的量为________mol。
Ⅱ、某研究性学习小组根据反应:2KMnO4+10FeSO4+8H2SO4===2MnSO4+5Fe2(SO4)3+K2SO4 + 8H2O设计如下原电池,其中甲、乙两烧杯中各物质的物质的量浓度均为 1 mol·L-1,溶液的体积均为200 mL,盐桥中装有饱和K2SO4溶液。

回答下列问题:
(3)此原电池的正极是石墨________(填“a”或“b”)。
(4)电池工作时,盐桥中的SO![]() 移向________(填“甲”或“乙”)烧杯。
移向________(填“甲”或“乙”)烧杯。
(5)甲烧杯中的电极反应式为_______________________。
(6)若不考虑溶液的体积变化,MnSO4浓度变为1.5 mol·L-1,则反应中转移的电子为____mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中不正确的有( )
①水是一种极弱的电解质,在常温下平均每n个水分子只有1个分子发生电离,n的值是55.6×107
②两种醋酸的物质的量浓度分别为c1和c2, pH分别为a和a+1,则c1=10c2
③常温下pH=4的醋酸加水稀释过程中,所有离子浓度都降低
④蒸干AlCl3溶液可得纯净的无水氯化铝
⑤常温下,等体积的pH=12的碱甲溶液和pH=11的碱乙溶液,分别用等浓度的盐酸中和时,消耗盐酸的体积为2V甲=V乙,则乙一定是弱碱
A. 1个 B. 2个 C. 3个 D. 4个
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮化铝广泛应用于电子陶瓷等工业领域。在一定条件下,AlN可通过以下反应合成:Al2O3+N2+3C![]() 2AlN+3CO。有关该反应下列叙述正确的是
2AlN+3CO。有关该反应下列叙述正确的是
A. AlN中氮的化合价为-3 B. 上述反应中,每消耗1 mol N2需转移3 mol电子
C. AlN的摩尔质量为41 g D. 上述反应中,N2是还原剂,Al2O3是氧化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锌及其化合物用途广泛。回答下列问题
(1)火法炼锌以闪锌矿(主要成分是ZnS) 为主要原料,涉及的主要反应有:
2ZnS(s)+3O2(g)=2ZnO(s)+2SO2(g) △H1=-930kJ·mol-1
C(s)+O2(g)=CO2(g) △H2=-393.5 kJ·mol-1
C(s)+CO2(g)=2CO(g) △H3= +172.5 kJ·mol-1
ZnO(s)+CO(g)=Zn(g)+CO2(g)△H4= +198 kJ·mol-1
反应ZnS(s)+tC(s)+2O2(g)=Zn(g)+CO2(g)+SO2(g)的△H =_________kJ·mol-1
(2)银锌蓄电池工作原理为Ag2O2+2Zn+2H2O![]() 2Ag +2Zn(OH)2,该蓄电池充电时,发生还原反应的物质是__________, 正极反应分为两个阶段,第二阶段为Ag2O+H2O+2e-= 2Ag+2OH-,写 出第一阶 段 正极 电极反应式_____________________________。
2Ag +2Zn(OH)2,该蓄电池充电时,发生还原反应的物质是__________, 正极反应分为两个阶段,第二阶段为Ag2O+H2O+2e-= 2Ag+2OH-,写 出第一阶 段 正极 电极反应式_____________________________。
(3)以(2)中蓄电池作电源,用如图所示的装置在实验室模拟铝制品表面“钝化”处理的过程中,发现溶液逐渐变浑浊,原因是__________________(用相关的电极反应式和离子方程式表示)。
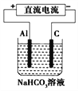
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有BaCl2和NaCl的混合溶液VL,将它分成两等份。一份滴加稀硫酸,使Ba2+完全沉淀;另一份滴加AgNO3溶液,使Cl-完全沉淀。反应中消耗amolH2SO4、bmolAgNO3。则原混合溶液中的c(Na+)为
A. ![]() mol/L B.
mol/L B. ![]() mol/L C.
mol/L C. ![]() mol/L D.
mol/L D. ![]() mol/L
mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】据报道,以NaBH4(B为+3价)和H2O2做原料的新型燃料电池可用作深水勘探等无空气环境下的电源,其结构如右图所示.该电池总反应式为:NaBH4+4H2O2=NaBO2+6H2O,下列的说法正确是( )

A. 放电过程中,Na+从右向左迁移
B. a为正极,其电极反应为:BH4--8e-+8OH-=BO2-+6H2O
C. b电极的电极反应式为:H2O2+2e-+2H+=2H2O
D. 每消耗300g、34%的H2O2溶液,理论上流过电路中的电子数为6NA个
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com