
【题目】Ⅰ、目前已开发出用电解法制取ClO2的新工艺。
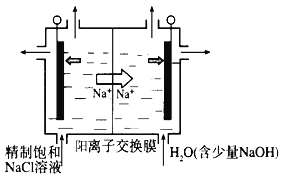
(1)图中用石墨做电极,在一定条件下电解饱和食盐水制取ClO2。则阳极产生ClO2的电极反应式为___________________________________________。
(2)电解一段时间,当阴极产生的气体体积为112 mL(标准状况)时,停止电解。通过阳离子交换膜的阳离子的物质的量为________mol。
Ⅱ、某研究性学习小组根据反应:2KMnO4+10FeSO4+8H2SO4===2MnSO4+5Fe2(SO4)3+K2SO4 + 8H2O设计如下原电池,其中甲、乙两烧杯中各物质的物质的量浓度均为 1 mol·L-1,溶液的体积均为200 mL,盐桥中装有饱和K2SO4溶液。

回答下列问题:
(3)此原电池的正极是石墨________(填“a”或“b”)。
(4)电池工作时,盐桥中的SO![]() 移向________(填“甲”或“乙”)烧杯。
移向________(填“甲”或“乙”)烧杯。
(5)甲烧杯中的电极反应式为_______________________。
(6)若不考虑溶液的体积变化,MnSO4浓度变为1.5 mol·L-1,则反应中转移的电子为____mol。
【答案】 Cl--5e-+2H2O===ClO2↑+4H+ 0.01 a 乙 MnO![]() +5e-+8H+===Mn2++4H2O 0.5
+5e-+8H+===Mn2++4H2O 0.5
【解析】试题分析:Ⅰ、(1)阳极Cl-失去电子发生氧化反应生成ClO2。(2)水电离产生的H+在阴极上放电产生氢气,转移电子的物质的量n=2n(H2)=2×(0.112 L÷22.4 L·mol-1)=0.01 mol,根据电荷守恒分析转移阳离子的物质的量。Ⅱ、(3)原电池中发生氧化反应的一极是负极,发生还原反应的一极是正极;(4)原电池中阳离子移向正极、阴离子移向负极;(5)甲烧杯中MnO![]() 得电子被还原为Mn2+; (6) MnSO4浓度由1 mol·L-1变为1.5 mol·L-1,则生成MnSO4的物质的量是0.2L×(1.5 mol·L-1-1 mol·L-1)=0.1mol,根据电极反应式计算转移电子的物质的量。
得电子被还原为Mn2+; (6) MnSO4浓度由1 mol·L-1变为1.5 mol·L-1,则生成MnSO4的物质的量是0.2L×(1.5 mol·L-1-1 mol·L-1)=0.1mol,根据电极反应式计算转移电子的物质的量。
解析:Ⅰ、(1)阳极Cl-失去电子发生氧化反应生成ClO2,电极反应是Cl--5e-+2H2O===ClO2↑+4H+。(2)水电离产生的H+在阴极上放电产生氢气,转移电子的物质的量n=2n(H2)=2×(0.112 L÷22.4 L·mol-1)=0.01 mol,溶液中阳离子全是+1价离子,根据电荷守恒,通过阳离子交换膜的阳离子的物质的量为0.01mol。Ⅱ、(3)原电池中发生氧化反应的一极是负极,发生还原反应的一极是正极;根据电池总反应方程式,KMnO4得电子发生还原反应,FeSO4失电子发生氧化反应;所以原电池的正极是石墨a; (4)原电池中阳离子移向正极、阴离子移向负极,所以盐桥中的SO![]() 移向乙烧杯;(5)甲烧杯中MnO
移向乙烧杯;(5)甲烧杯中MnO![]() 得电子被还原为Mn2+,电极反应是MnO
得电子被还原为Mn2+,电极反应是MnO![]() +5e-+8H+===Mn2++4H2O; (6) MnSO4浓度由1 mol·L-1变为1.5 mol·L-1,则生成MnSO4的物质的量是0.2L×(1.5 mol·L-1-1 mol·L-1)=0.1mol,根据电极反应MnO
+5e-+8H+===Mn2++4H2O; (6) MnSO4浓度由1 mol·L-1变为1.5 mol·L-1,则生成MnSO4的物质的量是0.2L×(1.5 mol·L-1-1 mol·L-1)=0.1mol,根据电极反应MnO![]() +5e-+8H+===Mn2++4H2O,生成0.1mol MnSO4转移电子的物质的量是0.5mol。
+5e-+8H+===Mn2++4H2O,生成0.1mol MnSO4转移电子的物质的量是0.5mol。


 小题狂做系列答案
小题狂做系列答案科目:高中化学 来源: 题型:
【题目】用图中所示装置进行实验,实验现象与预测不一致的是( )
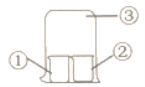
①中的物质 | ②中的物质 | 预测现象 | |
A | 饱和亚硫酸 | 蓝色石蕊试液 | ②中溶液先变红色又褪色 |
B | 饱和氯水 | 湿润红纸条 | ②中红纸条褪色 |
C | 浓双氧水 | H2S溶液 | ②中有淡黄色沉淀 |
D | 浓氨水 | 浓盐酸 | ③中有白烟 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向某密闭容器中充入1 mol CO和2 mol H2O(g),发生反应:CO+H2O(g)![]() CO2+H2。当反应达到平衡时,CO的体积分数为x。若维持容器的体积和温度不变,起始物质按下列四种配比充入该容器中,达到平衡时CO的体积分数大于x的是( )
CO2+H2。当反应达到平衡时,CO的体积分数为x。若维持容器的体积和温度不变,起始物质按下列四种配比充入该容器中,达到平衡时CO的体积分数大于x的是( )
A. 0.5 mol CO+2 mol H2O(g)+1 mol CO2+1 mol H2
B. 1 mol CO+1 mol H2O(g)+1 mol CO2+1 mol H2
C. 0.5 mol CO+1.5 mol H2O(g)+0.4 mol CO2+0.4 mol H2
D. 0.5 mol CO+1.5 mol H2O(g)+0.5 mol CO2+0.5 mol H2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】FeCl3可通过反应 3FeCl2+HNO3+3HCl→3FeC13+NO↑+2H2O 制得。
完成下列填空:
(1)上述反应式中由三原子组成的极性分子,其电子式为____________。
(2)限于上述反应式,原子最外层有3个未成对电子的主族元素是__________(填写名称);与它同周期、非金属性比它强的元素有_________(填写元素符号),非金属性较强的理由是___________________________________(请运用原子结构的知识解释)。
(3)上述反应中若有0.12mol电子发生转移,则可生成NO气体__________L(标准状况)。
(4)FeCl3浓溶液可用于蚀刻金属铜制作电路板。写出该反应的化学反应方程式。_____________________,实验室里,某同学将FeCl3(s)置于烧杯中,加水溶解配制溶液,为了加速固体溶解,边搅拌边加热,发现烧杯中出现浑浊。请用平衡移动原理解释出现浑浊的原因。_______________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
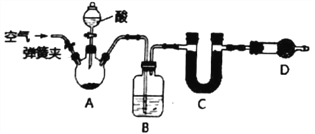
【题目】I.已知某纯碱试样中含有杂质NaCl,为了确定试样中纯碱的质量分数,可测定其在化学反应中生成CO2的质量,实验装置如下(铁架台及夹持仪器均已省略)。
完成下列填空:
(1)B装置中的试剂是_____________,作用是_____________________________。
(2)D装置的作用是___________________________________。
II.测定试样中纯碱质量分数的某次实验步骤如下:①将10.000g纯碱试样放入A中 ②称量C(U型管+碱石灰,下同),质量为l05.160g ③使用分液漏斗滴加足量的酸,使充分反应 ④打开A的弹簧夹,缓缓鼓入一定量的空气 ⑤再次称量C ⑥重复步骤④和⑤,最后得到C的质量为109.l66g。
(3)步骤③中,滴加的酸最好选用________。
a、浓硝酸 b、稀盐酸 c、浓硫酸 d、稀硫酸
当看到____________________现象时即可进行第④步操作。
(4)步骤⑥的目的是_______________________________________________。
(5)由实验数据可知,试样中纯碱的质量分数为_________________(保留3位小数)。
(6)甲同学用上述装置测定某试样中纯碱的质量分数,结果偏高,请帮助他找出造成实验误差的原因。_______________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钛酸钡粉体是电子陶瓷元器件的重要基础原料,其制备工艺流程图如下:
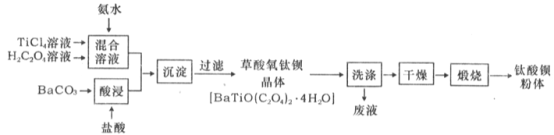
(l)草酸中碳元素的化合价为_____。
(2)为提高BaCO3的酸浸速率,可采取的措施为_____ (写出一条)。
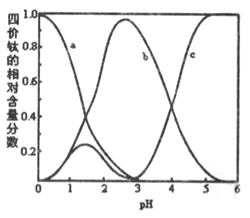
(3)“混合溶液”环节,钛元素在不同pH下主要以TiOC2O4、TiO(C2O4)22-、和TiO(OH)+三种形式存在,如图所示。实际制备工艺中,先用氨水调节混合溶液的pH于2.5~3之间,再进行“沉淀”,则上图中曲线a对应钛的形式为________(填化学式):写出“沉淀”时的离子方程式:__________。
(4)草酸氧钛钡晶体经蒸馏水数次洗涤后,证明它已被洗涤干净的实验方案____________。
(5)工业上TiCl4和BaCO3通常用如下方法制备:
①先将金红石(TiO2)与过量焦炭混合,再通人Cl2并加热到900℃制取TiCl4。请写出该法制取TiCl4的化学方程式:__________________________________。
②BaCO3是将重晶石(主要成分为BaSO4)浸泡在Na2CO3溶液中足够长时间来制备。请问Na2CO3溶液的浓度至少要大于______ mol·L-1才能开始转化。(已知常温下:Ksp(BaSO4)=1.0×10-10(mol·L-1)2,Ksp(BaCO3) =2.58×10-9(mol·L-1)2,忽略CO32-的水解)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下的密闭容器中发生反应:C(s)+CO2(g)=2CO(g).下列说法不正确的是( )
A.将碳块磨成粉末可加快反应速率
B.增加碳的质量可加快反应速率
C.升高温度可加快反应速率
D.容器体积不变时,向容器中充入氦气,反应速率不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列描述中正确的是( )
A. CS2为空间构型为V形的极性分子
B. 双原子或多原子形成的气体单质中,一定有σ键,可能有π键
C. 氢原子电子云的一个小黑点表示一个电子
D. HCN、SiF4和SO32-的中心原子均为sp3杂化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】环氧氯丙烷是制备环氧树脂的主要原料,工业上有不同的合成路线,以下是其中的一种(有些反应未注明条件)。
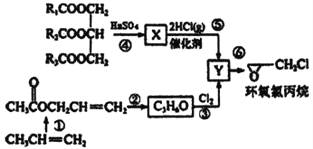
完成下列填空:
(1)X的结构简式_________Y中的不含氧官能团的名称为____________________
(2)反应①中的合成原料还有O2和醋酸及催化剂,写出该反应的化学方程式______________________。
(3)下列说法不正确的是__________
A.如R1、R2、R3不完全相同,则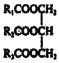 是混合物
是混合物
B.Y的结构简式是不能确定的,可能有两种不同的结构
C.反应②④⑤⑥都是取代反应
D.X与乙醇不是同系物,两者都能使酸性KMnO4溶液褪色
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com