
【题目】向某密闭容器中充入1 mol CO和2 mol H2O(g),发生反应:CO+H2O(g)![]() CO2+H2。当反应达到平衡时,CO的体积分数为x。若维持容器的体积和温度不变,起始物质按下列四种配比充入该容器中,达到平衡时CO的体积分数大于x的是( )
CO2+H2。当反应达到平衡时,CO的体积分数为x。若维持容器的体积和温度不变,起始物质按下列四种配比充入该容器中,达到平衡时CO的体积分数大于x的是( )
A. 0.5 mol CO+2 mol H2O(g)+1 mol CO2+1 mol H2
B. 1 mol CO+1 mol H2O(g)+1 mol CO2+1 mol H2
C. 0.5 mol CO+1.5 mol H2O(g)+0.4 mol CO2+0.4 mol H2
D. 0.5 mol CO+1.5 mol H2O(g)+0.5 mol CO2+0.5 mol H2
【答案】B
【解析】试题分析:A、用极限分析法,假如反应完全转化为一氧化碳和水,则为1.5摩尔和3摩尔,比例为1:2,反应前后气体体积不变,平衡等效,一氧化碳的体积分数为x,不选A;B、用极限分析法,假如反应完全转化为一氧化碳和水,则为2摩尔和2摩尔,比例为1:1,一氧化碳多,平衡正向移动,但一氧化碳的体积分数仍大于x,选B;C、用极限分析法,假如反应完全转化为一氧化碳和水,则为0.9摩尔和1.9摩尔,比例为9:19,说明水的量多,平衡正向移动,一氧化碳的体积分数小于x,不选C;D、用极限分析法,假如反应完全转化为一氧化碳和水,则为1摩尔和2摩尔,比例为1:2,反应前后气体体积不变,平衡等效,一氧化碳的体积分数为x,不选D.


科目:高中化学 来源: 题型:
【题目】常温下,取浓度均为0.1mol/L的HX溶液和ROH溶液各20mL,分别用0.1mol/LNaOH溶液、0.1mol·L-1盐酸进行滴定。滴定过程中溶液的pH随滴加溶液的体积变化关系如图所示。下列说法正确的是
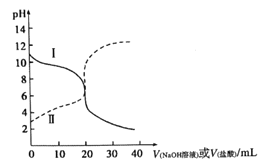
A. HX为强酸,ROH为弱碱
B. 滴定前,ROH溶液中存在c(ROH)>c(OH-)>c(R+)>c(H+)
C. 曲线Ⅱ:滴定至V=10mL时存在2c(OH-)-c(H+)=c(HX)-c(X-)
D. 滴定至V=40mL的过程中,两种溶液中由水电离出的c(H+)·c(OH-)不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有12.8g CO和CO2的混合气体,在标准状况下其体积为8.96 L。回答下列问题:
(1)该混合气体的平均摩尔质量为_____________。
(2)混合气体中碳原子的个数为___________(用NA表示阿伏加德罗常数的值)。
(3)将混合气体依次通过如图所示装置,最后收集在气球中(实验在标准状况下测定)。
①气球中收集到的气体为___________其体积为________L。
②被除去气体发生反应的离子方程式为_______________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列试剂保存或盛放方法正确的是( )
A.浓硝酸盛放在铜质器皿中
B.稀硝酸盛放在铁质器皿中
C.NaOH溶液保存在带橡胶塞的试剂瓶中
D.NaOH溶液保存在带玻璃塞的试剂瓶中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于下列各图的叙述,正确的是( )

A.甲表示H2与O2发生反应过程中的能量变化,则H2的燃烧热为483.6Kjmol﹣1
B.乙表示恒温恒容条件下发生的可逆反应2NO2![]() N2O4(g)中,各物质的浓度与其消耗速率之间的关系,其中交点A对应的状态为化学平衡状态
N2O4(g)中,各物质的浓度与其消耗速率之间的关系,其中交点A对应的状态为化学平衡状态
C.丙表示A、B两物质的溶解度随温度变化情况,将A、B饱和溶液分别由t1℃升温至t2℃时,溶质的质量分数B>A
D.丁表示常温下,稀释HA、HB两种酸的稀溶液时,溶液pH随加水量的变化,则同浓度的NaA溶液的pH小于NaB溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2016年IUPAC将117号元素命名为Ts(中文名“石田”,tián),Ts的原子核外最外层电子数是7。下列说法错误的是
A. Ts与F同主族 B. Ts的最外层p轨道中有5个电子
C. 在同族元素中Ts金属性最强 D. 中子数为176的Ts符号是![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关电解质溶液中粒子浓度关系正确的是( )
A. pH=1的NaHSO4溶液: c(H+)=c(SO![]() )+c(OH-)
)+c(OH-)
B. 含有AgCl和AgI固体的悬浊液: c(Ag+)>c(Cl-)=c(I-)
C. CO2的水溶液:c(H+)>c(HCO![]() )=2c(CO
)=2c(CO![]() )
)
D. 含等物质的量的NaHC2O4和Na2C2O4的溶液:3c(Na+)=2[c(HC2O![]() )+c(C2O
)+c(C2O![]() )+c(H2C2O4)]
)+c(H2C2O4)]
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ、目前已开发出用电解法制取ClO2的新工艺。
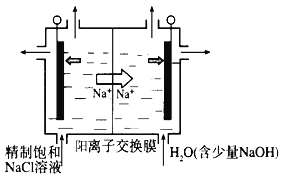
(1)图中用石墨做电极,在一定条件下电解饱和食盐水制取ClO2。则阳极产生ClO2的电极反应式为___________________________________________。
(2)电解一段时间,当阴极产生的气体体积为112 mL(标准状况)时,停止电解。通过阳离子交换膜的阳离子的物质的量为________mol。
Ⅱ、某研究性学习小组根据反应:2KMnO4+10FeSO4+8H2SO4===2MnSO4+5Fe2(SO4)3+K2SO4 + 8H2O设计如下原电池,其中甲、乙两烧杯中各物质的物质的量浓度均为 1 mol·L-1,溶液的体积均为200 mL,盐桥中装有饱和K2SO4溶液。

回答下列问题:
(3)此原电池的正极是石墨________(填“a”或“b”)。
(4)电池工作时,盐桥中的SO![]() 移向________(填“甲”或“乙”)烧杯。
移向________(填“甲”或“乙”)烧杯。
(5)甲烧杯中的电极反应式为_______________________。
(6)若不考虑溶液的体积变化,MnSO4浓度变为1.5 mol·L-1,则反应中转移的电子为____mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中不正确的有( )
①水是一种极弱的电解质,在常温下平均每n个水分子只有1个分子发生电离,n的值是55.6×107
②两种醋酸的物质的量浓度分别为c1和c2, pH分别为a和a+1,则c1=10c2
③常温下pH=4的醋酸加水稀释过程中,所有离子浓度都降低
④蒸干AlCl3溶液可得纯净的无水氯化铝
⑤常温下,等体积的pH=12的碱甲溶液和pH=11的碱乙溶液,分别用等浓度的盐酸中和时,消耗盐酸的体积为2V甲=V乙,则乙一定是弱碱
A. 1个 B. 2个 C. 3个 D. 4个
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com