
【题目】下列试剂保存或盛放方法正确的是( )
A.浓硝酸盛放在铜质器皿中
B.稀硝酸盛放在铁质器皿中
C.NaOH溶液保存在带橡胶塞的试剂瓶中
D.NaOH溶液保存在带玻璃塞的试剂瓶中
科目:高中化学 来源: 题型:
【题目】钛及其化合物的应用正越来越受到人们的关注。
(1)基态下原子核外电子排布的最高能级的符号是_____________。与钛同周期的元素中,基态原子的未成对电子数与钛相同的有_____种。
(2)钛比钢轻、比铝硬,是一种新兴的结构材料。钛硬度比铝大的原因是________________________。
(3)TiCl4是氯化法制取钛的中间产物。TiCl4和SiCl4在常温下都是液体,分子结构相同。采用蒸馏的方法分离SiCl4和TiCl4的混合物,先获得的馏分是______________(填化学式)。
(4)半夹心结构催化剂M能催化乙烯、丙烯、苯乙烯等的聚合,其结构如右图所示。

①组成该物质的元素中,电负性最大的是____________ (填元素名称)。
②M中,碳原子的杂化形式有________种。
③M中,不含_________(填标号)。
a. π键 b. σ键 c.配位键 d.氢键 e.离子键
(5)金红石(TiO2)是含钛的主要矿物之一,具有四方晶系结构。其晶胞结构(晶胞中相同位置的原子相同)如下图所示。

①4个微粒A、B、C、D中,属于氧原子的是______________。
②若A、B、C的原子坐标分别为A (0,0,0)、B (0.69a,0.69a,c)、c (a, a,c),则D的原子坐标为D (0.19a,_____,______);钛氧键的键长d=________________(用代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用图中所示装置进行实验,实验现象与预测不一致的是( )
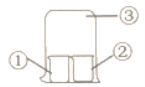
①中的物质 | ②中的物质 | 预测现象 | |
A | 饱和亚硫酸 | 蓝色石蕊试液 | ②中溶液先变红色又褪色 |
B | 饱和氯水 | 湿润红纸条 | ②中红纸条褪色 |
C | 浓双氧水 | H2S溶液 | ②中有淡黄色沉淀 |
D | 浓氨水 | 浓盐酸 | ③中有白烟 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮化钠(Na3N)和叠氮酸钠(NaN3)是氮和钠的两种重要化合物。Na3N能与水反应: ![]() 。
。
(1)写出该反应产物中属于离子化合物的电子式:_______________。
(2)写出Na3N与足量盐酸反应的化学方程式:______________________________________。
(3)将该反应中四种元素的简单离子按离子半径由大到小的顺序排列:___________________。
(4)该反应四种元素中的三种,能组成一种在水溶液中显酸性的盐,写出该盐的化学式:______。
(5)O元素的非金属性比N元素强,请用一个事实说明:____________________________。
(6)叠氮酸钠(NaN3)受撞击会分解: ![]() ,故NaN3可应用于汽车安全气囊,若产生67.2L(标准状况下)氮气,则该反应中转移电子______________个。
,故NaN3可应用于汽车安全气囊,若产生67.2L(标准状况下)氮气,则该反应中转移电子______________个。
(7)叠氮酸(HN3)是弱酸,酸性与醋酸相似,写出HN3的电离方程式:___________________;将NaN3水溶液中的离子按浓度由大到小排序:__________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向某密闭容器中充入1 mol CO和2 mol H2O(g),发生反应:CO+H2O(g)![]() CO2+H2。当反应达到平衡时,CO的体积分数为x。若维持容器的体积和温度不变,起始物质按下列四种配比充入该容器中,达到平衡时CO的体积分数大于x的是( )
CO2+H2。当反应达到平衡时,CO的体积分数为x。若维持容器的体积和温度不变,起始物质按下列四种配比充入该容器中,达到平衡时CO的体积分数大于x的是( )
A. 0.5 mol CO+2 mol H2O(g)+1 mol CO2+1 mol H2
B. 1 mol CO+1 mol H2O(g)+1 mol CO2+1 mol H2
C. 0.5 mol CO+1.5 mol H2O(g)+0.4 mol CO2+0.4 mol H2
D. 0.5 mol CO+1.5 mol H2O(g)+0.5 mol CO2+0.5 mol H2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】FeCl3可通过反应 3FeCl2+HNO3+3HCl→3FeC13+NO↑+2H2O 制得。
完成下列填空:
(1)上述反应式中由三原子组成的极性分子,其电子式为____________。
(2)限于上述反应式,原子最外层有3个未成对电子的主族元素是__________(填写名称);与它同周期、非金属性比它强的元素有_________(填写元素符号),非金属性较强的理由是___________________________________(请运用原子结构的知识解释)。
(3)上述反应中若有0.12mol电子发生转移,则可生成NO气体__________L(标准状况)。
(4)FeCl3浓溶液可用于蚀刻金属铜制作电路板。写出该反应的化学反应方程式。_____________________,实验室里,某同学将FeCl3(s)置于烧杯中,加水溶解配制溶液,为了加速固体溶解,边搅拌边加热,发现烧杯中出现浑浊。请用平衡移动原理解释出现浑浊的原因。_______________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列描述中正确的是( )
A. CS2为空间构型为V形的极性分子
B. 双原子或多原子形成的气体单质中,一定有σ键,可能有π键
C. 氢原子电子云的一个小黑点表示一个电子
D. HCN、SiF4和SO32-的中心原子均为sp3杂化
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com