
【题目】用图中所示装置进行实验,实验现象与预测不一致的是( )
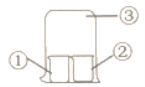
①中的物质 | ②中的物质 | 预测现象 | |
A | 饱和亚硫酸 | 蓝色石蕊试液 | ②中溶液先变红色又褪色 |
B | 饱和氯水 | 湿润红纸条 | ②中红纸条褪色 |
C | 浓双氧水 | H2S溶液 | ②中有淡黄色沉淀 |
D | 浓氨水 | 浓盐酸 | ③中有白烟 |
A. A B. B C. C D. D
科目:高中化学 来源: 题型:
【题目】常温下,取浓度均为0.1mol/L的HX溶液和ROH溶液各20mL,分别用0.1mol/LNaOH溶液、0.1mol·L-1盐酸进行滴定。滴定过程中溶液的pH随滴加溶液的体积变化关系如图所示。下列说法正确的是
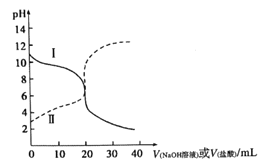
A. HX为强酸,ROH为弱碱
B. 滴定前,ROH溶液中存在c(ROH)>c(OH-)>c(R+)>c(H+)
C. 曲线Ⅱ:滴定至V=10mL时存在2c(OH-)-c(H+)=c(HX)-c(X-)
D. 滴定至V=40mL的过程中,两种溶液中由水电离出的c(H+)·c(OH-)不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对下列图像描述正确的是( )
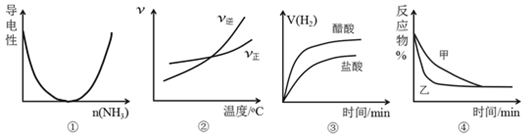
A. 图①可表示将氨气通入醋酸溶液至过量过程中溶液导电性的变化
B. 根据图②可判断可逆反应A2(g)+3B2(g)![]() 2AB3(g)的ΔH>0
2AB3(g)的ΔH>0
C. 图③表示等体积、等pH的盐酸与醋酸溶液分别与足量的镁粉发生反应产生氢气的体积(V)随时的变化的示意图
D. 图④表示压强对可逆反应A(g)+B(g)![]() 2C(g)+D(g)的影响,乙的压强大
2C(g)+D(g)的影响,乙的压强大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对C2H6和C5H12的分析错误的是( )
A. 互为同系物
B. C2H6失去1个H得到的乙基只有一种结构
C. C5H12的一氯代物可能只有一种
D. 2,2-二甲基丙烷的沸点高于其同分异构体的沸点
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用碳酸钠晶体(Na2CO3·10H2O)配制0.2 mol·L-1的Na2CO3溶液480 mL。
(1)本实验用到的仪器除托盘天平、烧杯、玻璃棒、胶头滴管外还需要______________,应称取Na2CO3·10H2O晶体的质量为________克。
(2)下列操作中,容量瓶所不具备的功能有________。
A.配制一定体积准确浓度的标准溶液 B.贮存溶液
C.测量容量瓶规格以下的任意体积的液体 D.用来加热溶解固体溶质
(3)配制0.2 mol·L-1的Na2CO3溶液480 mL的主要步骤有:①溶解 ②计算 ③转移洗涤 ④定容摇匀 ⑤称量;正确的操作顺序是:_____________________。(填序号)
(4)根据下列操作对所配溶液浓度偏高的有(填序号)____________。
①碳酸钠晶体失去了部分结晶水 ②用“左码右物”的称量方法称量晶体
③碳酸钠晶体不纯,其中混有氯化钠④定容时俯视
⑤容量瓶未经干燥就使用 ⑥定容摇匀后,发现]液面低于刻度线,再加水到刻度线
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有12.8g CO和CO2的混合气体,在标准状况下其体积为8.96 L。回答下列问题:
(1)该混合气体的平均摩尔质量为_____________。
(2)混合气体中碳原子的个数为___________(用NA表示阿伏加德罗常数的值)。
(3)将混合气体依次通过如图所示装置,最后收集在气球中(实验在标准状况下测定)。
①气球中收集到的气体为___________其体积为________L。
②被除去气体发生反应的离子方程式为_______________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列试剂保存或盛放方法正确的是( )
A.浓硝酸盛放在铜质器皿中
B.稀硝酸盛放在铁质器皿中
C.NaOH溶液保存在带橡胶塞的试剂瓶中
D.NaOH溶液保存在带玻璃塞的试剂瓶中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ、目前已开发出用电解法制取ClO2的新工艺。
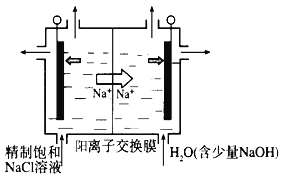
(1)图中用石墨做电极,在一定条件下电解饱和食盐水制取ClO2。则阳极产生ClO2的电极反应式为___________________________________________。
(2)电解一段时间,当阴极产生的气体体积为112 mL(标准状况)时,停止电解。通过阳离子交换膜的阳离子的物质的量为________mol。
Ⅱ、某研究性学习小组根据反应:2KMnO4+10FeSO4+8H2SO4===2MnSO4+5Fe2(SO4)3+K2SO4 + 8H2O设计如下原电池,其中甲、乙两烧杯中各物质的物质的量浓度均为 1 mol·L-1,溶液的体积均为200 mL,盐桥中装有饱和K2SO4溶液。

回答下列问题:
(3)此原电池的正极是石墨________(填“a”或“b”)。
(4)电池工作时,盐桥中的SO![]() 移向________(填“甲”或“乙”)烧杯。
移向________(填“甲”或“乙”)烧杯。
(5)甲烧杯中的电极反应式为_______________________。
(6)若不考虑溶液的体积变化,MnSO4浓度变为1.5 mol·L-1,则反应中转移的电子为____mol。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com