
【题目】在一定条件下的密闭容器中发生反应:C(s)+CO2(g)=2CO(g).下列说法不正确的是( )
A.将碳块磨成粉末可加快反应速率
B.增加碳的质量可加快反应速率
C.升高温度可加快反应速率
D.容器体积不变时,向容器中充入氦气,反应速率不变
科目:高中化学 来源: 题型:
【题目】现有12.8g CO和CO2的混合气体,在标准状况下其体积为8.96 L。回答下列问题:
(1)该混合气体的平均摩尔质量为_____________。
(2)混合气体中碳原子的个数为___________(用NA表示阿伏加德罗常数的值)。
(3)将混合气体依次通过如图所示装置,最后收集在气球中(实验在标准状况下测定)。
①气球中收集到的气体为___________其体积为________L。
②被除去气体发生反应的离子方程式为_______________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关电解质溶液中粒子浓度关系正确的是( )
A. pH=1的NaHSO4溶液: c(H+)=c(SO![]() )+c(OH-)
)+c(OH-)
B. 含有AgCl和AgI固体的悬浊液: c(Ag+)>c(Cl-)=c(I-)
C. CO2的水溶液:c(H+)>c(HCO![]() )=2c(CO
)=2c(CO![]() )
)
D. 含等物质的量的NaHC2O4和Na2C2O4的溶液:3c(Na+)=2[c(HC2O![]() )+c(C2O
)+c(C2O![]() )+c(H2C2O4)]
)+c(H2C2O4)]
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ、目前已开发出用电解法制取ClO2的新工艺。
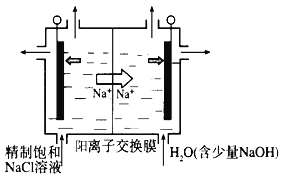
(1)图中用石墨做电极,在一定条件下电解饱和食盐水制取ClO2。则阳极产生ClO2的电极反应式为___________________________________________。
(2)电解一段时间,当阴极产生的气体体积为112 mL(标准状况)时,停止电解。通过阳离子交换膜的阳离子的物质的量为________mol。
Ⅱ、某研究性学习小组根据反应:2KMnO4+10FeSO4+8H2SO4===2MnSO4+5Fe2(SO4)3+K2SO4 + 8H2O设计如下原电池,其中甲、乙两烧杯中各物质的物质的量浓度均为 1 mol·L-1,溶液的体积均为200 mL,盐桥中装有饱和K2SO4溶液。

回答下列问题:
(3)此原电池的正极是石墨________(填“a”或“b”)。
(4)电池工作时,盐桥中的SO![]() 移向________(填“甲”或“乙”)烧杯。
移向________(填“甲”或“乙”)烧杯。
(5)甲烧杯中的电极反应式为_______________________。
(6)若不考虑溶液的体积变化,MnSO4浓度变为1.5 mol·L-1,则反应中转移的电子为____mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知4NH3+5O2 ![]() 4NO+6H2O(g),若反应速率分别用v(NH3)、v(O2)、v(NO)、v(H2O)[mol·L-1·min-1]表示,则正确的关系是( )
4NO+6H2O(g),若反应速率分别用v(NH3)、v(O2)、v(NO)、v(H2O)[mol·L-1·min-1]表示,则正确的关系是( )
A.![]() v(NH3)=v(O2) B.
v(NH3)=v(O2) B.![]() v(O2)=v(H2O)
v(O2)=v(H2O)
C.![]() v(NH3)=v(H2O) D.
v(NH3)=v(H2O) D.![]() v(O2)=v(NO)
v(O2)=v(NO)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各反应中属于加成反应的是
A.CH4+2O2→CO2+2H2OB.CH2=CH2+H-OH→CH3-CH2OH
C.CH4+Cl2→CH3Cl+HClD.HCl+AgNO3=AgCl↓+HNO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中不正确的有( )
①水是一种极弱的电解质,在常温下平均每n个水分子只有1个分子发生电离,n的值是55.6×107
②两种醋酸的物质的量浓度分别为c1和c2, pH分别为a和a+1,则c1=10c2
③常温下pH=4的醋酸加水稀释过程中,所有离子浓度都降低
④蒸干AlCl3溶液可得纯净的无水氯化铝
⑤常温下,等体积的pH=12的碱甲溶液和pH=11的碱乙溶液,分别用等浓度的盐酸中和时,消耗盐酸的体积为2V甲=V乙,则乙一定是弱碱
A. 1个 B. 2个 C. 3个 D. 4个
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锌及其化合物用途广泛。回答下列问题
(1)火法炼锌以闪锌矿(主要成分是ZnS) 为主要原料,涉及的主要反应有:
2ZnS(s)+3O2(g)=2ZnO(s)+2SO2(g) △H1=-930kJ·mol-1
C(s)+O2(g)=CO2(g) △H2=-393.5 kJ·mol-1
C(s)+CO2(g)=2CO(g) △H3= +172.5 kJ·mol-1
ZnO(s)+CO(g)=Zn(g)+CO2(g)△H4= +198 kJ·mol-1
反应ZnS(s)+tC(s)+2O2(g)=Zn(g)+CO2(g)+SO2(g)的△H =_________kJ·mol-1
(2)银锌蓄电池工作原理为Ag2O2+2Zn+2H2O![]() 2Ag +2Zn(OH)2,该蓄电池充电时,发生还原反应的物质是__________, 正极反应分为两个阶段,第二阶段为Ag2O+H2O+2e-= 2Ag+2OH-,写 出第一阶 段 正极 电极反应式_____________________________。
2Ag +2Zn(OH)2,该蓄电池充电时,发生还原反应的物质是__________, 正极反应分为两个阶段,第二阶段为Ag2O+H2O+2e-= 2Ag+2OH-,写 出第一阶 段 正极 电极反应式_____________________________。
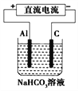
(3)以(2)中蓄电池作电源,用如图所示的装置在实验室模拟铝制品表面“钝化”处理的过程中,发现溶液逐渐变浑浊,原因是__________________(用相关的电极反应式和离子方程式表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com