
【题目】下列各反应中属于加成反应的是
A.CH4+2O2→CO2+2H2OB.CH2=CH2+H-OH→CH3-CH2OH
C.CH4+Cl2→CH3Cl+HClD.HCl+AgNO3=AgCl↓+HNO3
 全能测控一本好卷系列答案
全能测控一本好卷系列答案 发散思维新课堂系列答案
发散思维新课堂系列答案科目:高中化学 来源: 题型:
【题目】氮化钠(Na3N)和叠氮酸钠(NaN3)是氮和钠的两种重要化合物。Na3N能与水反应: ![]() 。
。
(1)写出该反应产物中属于离子化合物的电子式:_______________。
(2)写出Na3N与足量盐酸反应的化学方程式:______________________________________。
(3)将该反应中四种元素的简单离子按离子半径由大到小的顺序排列:___________________。
(4)该反应四种元素中的三种,能组成一种在水溶液中显酸性的盐,写出该盐的化学式:______。
(5)O元素的非金属性比N元素强,请用一个事实说明:____________________________。
(6)叠氮酸钠(NaN3)受撞击会分解: ![]() ,故NaN3可应用于汽车安全气囊,若产生67.2L(标准状况下)氮气,则该反应中转移电子______________个。
,故NaN3可应用于汽车安全气囊,若产生67.2L(标准状况下)氮气,则该反应中转移电子______________个。
(7)叠氮酸(HN3)是弱酸,酸性与醋酸相似,写出HN3的电离方程式:___________________;将NaN3水溶液中的离子按浓度由大到小排序:__________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】FeCl3可通过反应 3FeCl2+HNO3+3HCl→3FeC13+NO↑+2H2O 制得。
完成下列填空:
(1)上述反应式中由三原子组成的极性分子,其电子式为____________。
(2)限于上述反应式,原子最外层有3个未成对电子的主族元素是__________(填写名称);与它同周期、非金属性比它强的元素有_________(填写元素符号),非金属性较强的理由是___________________________________(请运用原子结构的知识解释)。
(3)上述反应中若有0.12mol电子发生转移,则可生成NO气体__________L(标准状况)。
(4)FeCl3浓溶液可用于蚀刻金属铜制作电路板。写出该反应的化学反应方程式。_____________________,实验室里,某同学将FeCl3(s)置于烧杯中,加水溶解配制溶液,为了加速固体溶解,边搅拌边加热,发现烧杯中出现浑浊。请用平衡移动原理解释出现浑浊的原因。_______________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钛酸钡粉体是电子陶瓷元器件的重要基础原料,其制备工艺流程图如下:
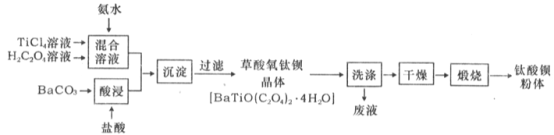
(l)草酸中碳元素的化合价为_____。
(2)为提高BaCO3的酸浸速率,可采取的措施为_____ (写出一条)。
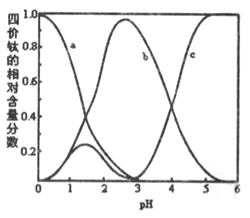
(3)“混合溶液”环节,钛元素在不同pH下主要以TiOC2O4、TiO(C2O4)22-、和TiO(OH)+三种形式存在,如图所示。实际制备工艺中,先用氨水调节混合溶液的pH于2.5~3之间,再进行“沉淀”,则上图中曲线a对应钛的形式为________(填化学式):写出“沉淀”时的离子方程式:__________。
(4)草酸氧钛钡晶体经蒸馏水数次洗涤后,证明它已被洗涤干净的实验方案____________。
(5)工业上TiCl4和BaCO3通常用如下方法制备:
①先将金红石(TiO2)与过量焦炭混合,再通人Cl2并加热到900℃制取TiCl4。请写出该法制取TiCl4的化学方程式:__________________________________。
②BaCO3是将重晶石(主要成分为BaSO4)浸泡在Na2CO3溶液中足够长时间来制备。请问Na2CO3溶液的浓度至少要大于______ mol·L-1才能开始转化。(已知常温下:Ksp(BaSO4)=1.0×10-10(mol·L-1)2,Ksp(BaCO3) =2.58×10-9(mol·L-1)2,忽略CO32-的水解)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下的密闭容器中发生反应:C(s)+CO2(g)=2CO(g).下列说法不正确的是( )
A.将碳块磨成粉末可加快反应速率
B.增加碳的质量可加快反应速率
C.升高温度可加快反应速率
D.容器体积不变时,向容器中充入氦气,反应速率不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A.甲烷分子中的所有原子处于同一平面上
B.煤的液化、气化和干馏均属于化学变化
C.乙炔和溴的四氯化碳溶液发生加成反应而使其褪色
D.苯分子中不存在碳碳单键和碳碳双键交替出现的结构
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列描述中正确的是( )
A. CS2为空间构型为V形的极性分子
B. 双原子或多原子形成的气体单质中,一定有σ键,可能有π键
C. 氢原子电子云的一个小黑点表示一个电子
D. HCN、SiF4和SO32-的中心原子均为sp3杂化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法合理的是
①根据纯净物中是否含氧元素,来判断是否属于氧化物
②根据电泳现象可证明胶体带电荷
③直径介于lnm~l00nm之间的微粒称为胶体
④金属氧化物都是碱性氧化物
⑤根据分散系的稳定性将分散系分为胶体、溶液和浊液
⑥同一钢笔使用不同牌号的墨水容易堵塞,是由于胶体的聚沉
A. 只有⑥ B. 只有②⑥ C. 只有③④⑤ D. 只有①②④⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化铁是一种重要的化学试剂,其晶体的化学式为FeCl3·6H2O。FeCl3的饱和溶液在实验室和电子工业中都有重要应用。
(1)饱和FeCl3溶液的颜色是______________色的,实验室里常用它来制备______________(化学式)胶体,具体操作方法是:先将烧杯中的水加热至沸腾,再滴入5~6滴____________________,______________至液体呈______________色,停止加热。
(2)电子工业中 ,常用FeCl3的饱和溶液来印刷电路图板,反应的原理是:Cu+2FeCl3=2FeCl2+CuCl2。该反应中______________作氧化剂,用单线桥法表示电子转移的方向和数目:____________。
(3)将0.5mol·L—1的FeCl3溶液从100mL稀释至500mL,所得溶液中,c(Cl—)为__________。(写出计算过程)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com