
【题目】有BaCl2和NaCl的混合溶液VL,将它分成两等份。一份滴加稀硫酸,使Ba2+完全沉淀;另一份滴加AgNO3溶液,使Cl-完全沉淀。反应中消耗amolH2SO4、bmolAgNO3。则原混合溶液中的c(Na+)为
A. ![]() mol/L B.
mol/L B. ![]() mol/L C.
mol/L C. ![]() mol/L D.
mol/L D. ![]() mol/L
mol/L
【答案】A
【解析】
由BaCl2和稀硫酸反应可计算Ba2+离子的物质的量,利用NaCl和AgNO3溶液反应计算出Cl-离子的物质的量,由混合液呈电中性可计算出钠离子的物质的量,并注意均分成两份及计算原混合溶液中的c(Na+)。
BaCl2和NaCl的混合溶液VL,将它均分成两份,一份滴加稀硫酸,使Ba2+完全沉淀,消耗xmolH2SO4,则溶液中c(Ba2+)=a/0.5Vmol/L,另一份滴加AgNO3溶液,使Cl-完全沉淀,反应中消耗ymolAgNO3,则c(Cl-)= b/0.5Vmol/L,由电荷守恒可得2c(Ba2+)+ c(Na+)= c(Cl-),则c(Na+)= b/0.5Vmol/L—2×a/0.5Vmol/L=(2b-4a)/Vmol/L,故选A。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】下列描述中正确的是( )
A. CS2为空间构型为V形的极性分子
B. 双原子或多原子形成的气体单质中,一定有σ键,可能有π键
C. 氢原子电子云的一个小黑点表示一个电子
D. HCN、SiF4和SO32-的中心原子均为sp3杂化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】环氧氯丙烷是制备环氧树脂的主要原料,工业上有不同的合成路线,以下是其中的一种(有些反应未注明条件)。
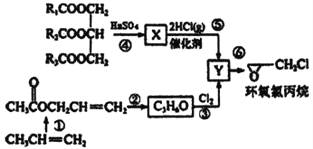
完成下列填空:
(1)X的结构简式_________Y中的不含氧官能团的名称为____________________
(2)反应①中的合成原料还有O2和醋酸及催化剂,写出该反应的化学方程式______________________。
(3)下列说法不正确的是__________
A.如R1、R2、R3不完全相同,则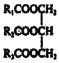 是混合物
是混合物
B.Y的结构简式是不能确定的,可能有两种不同的结构
C.反应②④⑤⑥都是取代反应
D.X与乙醇不是同系物,两者都能使酸性KMnO4溶液褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化铁是一种重要的化学试剂,其晶体的化学式为FeCl3·6H2O。FeCl3的饱和溶液在实验室和电子工业中都有重要应用。
(1)饱和FeCl3溶液的颜色是______________色的,实验室里常用它来制备______________(化学式)胶体,具体操作方法是:先将烧杯中的水加热至沸腾,再滴入5~6滴____________________,______________至液体呈______________色,停止加热。
(2)电子工业中 ,常用FeCl3的饱和溶液来印刷电路图板,反应的原理是:Cu+2FeCl3=2FeCl2+CuCl2。该反应中______________作氧化剂,用单线桥法表示电子转移的方向和数目:____________。
(3)将0.5mol·L—1的FeCl3溶液从100mL稀释至500mL,所得溶液中,c(Cl—)为__________。(写出计算过程)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏伽德罗常数的值。下列有关叙述正确的是( )
A. 24g镁在足量的O2中燃烧,转移的电子数为0.1NA
B. 分子总数为NA的NO2和CO2混合气体中含有的氧原子數为2NA
C. 1L一氧化碳气体一定比1L氧气的质量小
D. 常温常压下8gO3中含有8NA个电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列常见物质的俗名与化学式相对应的是( )
A.胆矾——CuSO4·5H2OB.烧碱——Na2CO3
C.小苏打——Na2SO4D.明矾——Al2(SO4)3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请用C、H、O、N、S五种元素回答下列问题
(1)除H外,其它四种元素中,第一电离能最大的元素基态原子电子排布图为______________,电负性最大的元素基态原子核外电子运动状态共有_________种。
(2)五种元素中,由其中两种元素构成甲、乙、丙、丁四种分子,所含原子的数目依次为3、4、6、8,都含有18个电子。甲和乙的主要物理性质比较如下:
熔点/K | 沸点/K | 标准状况时在水中的溶解度 | |
甲 | 187 | 202 | 2.6 |
乙 | 272 | 423 | 以任意比互溶 |
①1mol乙分子含有_________个σ键;
②丁分子的中心原子采取_________杂化方式;甲分子的VSEPR模型为_________,丙分子为_________(“极性”或“非极性”)分子。
③甲和乙的相对分子质量基本相同,造成上述物理性质差异的主要原因是:____________________(结合具体物质解释)。
(3)已知
化学键 | N-N | N=N | N | C-C | C=C | C |
键能/kJ·mol-1 | 193 | 418 | 946 | 347.7 | 615 | 812 |
由以上数据可知,氮气比乙烯、乙炔难发生加成反应,原因是____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A. 基态氧原子与基态氮原子中未成对电子数之比是2∶3
B. 基态氮原子与基态磷原子中未成对电子数之比是1∶1
C. 基态碳原子与基态氮原子中未成对电子数之比是3∶4
D. 基态铜原子中未成对电子数是1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com