
【题目】请用C、H、O、N、S五种元素回答下列问题
(1)除H外,其它四种元素中,第一电离能最大的元素基态原子电子排布图为______________,电负性最大的元素基态原子核外电子运动状态共有_________种。
(2)五种元素中,由其中两种元素构成甲、乙、丙、丁四种分子,所含原子的数目依次为3、4、6、8,都含有18个电子。甲和乙的主要物理性质比较如下:
熔点/K | 沸点/K | 标准状况时在水中的溶解度 | |
甲 | 187 | 202 | 2.6 |
乙 | 272 | 423 | 以任意比互溶 |
①1mol乙分子含有_________个σ键;
②丁分子的中心原子采取_________杂化方式;甲分子的VSEPR模型为_________,丙分子为_________(“极性”或“非极性”)分子。
③甲和乙的相对分子质量基本相同,造成上述物理性质差异的主要原因是:____________________(结合具体物质解释)。
(3)已知
化学键 | N-N | N=N | N | C-C | C=C | C |
键能/kJ·mol-1 | 193 | 418 | 946 | 347.7 | 615 | 812 |
由以上数据可知,氮气比乙烯、乙炔难发生加成反应,原因是____________________。
【答案】 ![]() 8 3NA sp3 四面体 极性 H2O2分子间存在氢键,因此熔沸点高于H2S,H2O2分子与水分子可形成氢键因此溶解性好 氮气分子中三键、双键键能分别大于单键键能的3倍和2倍,而乙炔分子中的三键键能和乙烯分子中双键键能分别小于单键键能的3倍和2倍,说明C原子间的π键比较活泼,易发生加成反应
8 3NA sp3 四面体 极性 H2O2分子间存在氢键,因此熔沸点高于H2S,H2O2分子与水分子可形成氢键因此溶解性好 氮气分子中三键、双键键能分别大于单键键能的3倍和2倍,而乙炔分子中的三键键能和乙烯分子中双键键能分别小于单键键能的3倍和2倍,说明C原子间的π键比较活泼,易发生加成反应
【解析】(1)同一周期元素中,元素的第一电离能随着原子序数的增大而呈增大趋势,但第IIA族、第VA族元素的第一电离能大于相邻元素。同族元素:从上至下第一电离能逐渐减小。
除H外,其它四种元素中,第一电离能最大的元素为N,N的基态原子电子排布图为![]() ;同周期自左而右电负性增大,同主族自上而下电负性降低,非金属性越强电负性越强,电负性最大的元素为O,O核外有8个电子,基态原子核外电子运动状态共有8种,故答案为:
;同周期自左而右电负性增大,同主族自上而下电负性降低,非金属性越强电负性越强,电负性最大的元素为O,O核外有8个电子,基态原子核外电子运动状态共有8种,故答案为:![]() ;8;
;8;
(2)C、H、O、N、S五种元素中,由其中两种元素构成甲、乙、丙、丁四种分子,所含原子的数目依次为3、4、6、8,都含有18个电子。甲在水中的溶解度较小,熔沸点较低,则为H2S,乙分子中含有4个原子,与水以任意比互溶,沸点较高,乙为H2O2,丙分子中含有6个原子,为N2H4,丁分子中含有8个原子,为C2H6。
①过氧化氢的电子式为![]() ,1molH2O2分子含有3molσ键,故答案为:3NA;
,1molH2O2分子含有3molσ键,故答案为:3NA;
②C2H6分子中碳原子形成3个C-H,1个C-C双键,C原子杂化轨道数为(3+1)=4,C原子采取sp3杂化方式;H2S分子中S的价层电子对数目=2+![]() (6-1×2)=4,VSEPR模型为四面体,N2H4分子为中电荷分布不均匀,属于极性分子,故答案为:3NA; sp3;四面体;极性;
(6-1×2)=4,VSEPR模型为四面体,N2H4分子为中电荷分布不均匀,属于极性分子,故答案为:3NA; sp3;四面体;极性;
③H2O2分子间存在氢键,所以熔沸点比H2S高;H2O2分子与水分子可形成氢键,所以与任意比互溶;故答案为:H2O2分子间存在氢键,因此熔沸点更高;H2O2与水分子可形成氢键,可以与水任意比互溶;
(3)根据表格数据可知,氮气分子中三键、双键键能分别大于单键键能的3倍和2倍,而乙炔分子中的三键键能和乙烯分子中双键键能分别小于单键键能的3倍和2倍,说明C原子间的π键比较活泼,易发生加成反应,故答案为:氮气分子中三键、双键键能分别大于单键键能的3倍和2倍,而乙炔分子中的三键键能和乙烯分子中双键键能分别小于单键键能的3倍和2倍,说明C原子间的π键比较活泼,易发生加成反应。


科目:高中化学 来源: 题型:
【题目】下列说法中不正确的有( )
①水是一种极弱的电解质,在常温下平均每n个水分子只有1个分子发生电离,n的值是55.6×107
②两种醋酸的物质的量浓度分别为c1和c2, pH分别为a和a+1,则c1=10c2
③常温下pH=4的醋酸加水稀释过程中,所有离子浓度都降低
④蒸干AlCl3溶液可得纯净的无水氯化铝
⑤常温下,等体积的pH=12的碱甲溶液和pH=11的碱乙溶液,分别用等浓度的盐酸中和时,消耗盐酸的体积为2V甲=V乙,则乙一定是弱碱
A. 1个 B. 2个 C. 3个 D. 4个
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锌及其化合物用途广泛。回答下列问题
(1)火法炼锌以闪锌矿(主要成分是ZnS) 为主要原料,涉及的主要反应有:
2ZnS(s)+3O2(g)=2ZnO(s)+2SO2(g) △H1=-930kJ·mol-1
C(s)+O2(g)=CO2(g) △H2=-393.5 kJ·mol-1
C(s)+CO2(g)=2CO(g) △H3= +172.5 kJ·mol-1
ZnO(s)+CO(g)=Zn(g)+CO2(g)△H4= +198 kJ·mol-1
反应ZnS(s)+tC(s)+2O2(g)=Zn(g)+CO2(g)+SO2(g)的△H =_________kJ·mol-1
(2)银锌蓄电池工作原理为Ag2O2+2Zn+2H2O![]() 2Ag +2Zn(OH)2,该蓄电池充电时,发生还原反应的物质是__________, 正极反应分为两个阶段,第二阶段为Ag2O+H2O+2e-= 2Ag+2OH-,写 出第一阶 段 正极 电极反应式_____________________________。
2Ag +2Zn(OH)2,该蓄电池充电时,发生还原反应的物质是__________, 正极反应分为两个阶段,第二阶段为Ag2O+H2O+2e-= 2Ag+2OH-,写 出第一阶 段 正极 电极反应式_____________________________。
(3)以(2)中蓄电池作电源,用如图所示的装置在实验室模拟铝制品表面“钝化”处理的过程中,发现溶液逐渐变浑浊,原因是__________________(用相关的电极反应式和离子方程式表示)。
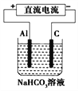
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有BaCl2和NaCl的混合溶液VL,将它分成两等份。一份滴加稀硫酸,使Ba2+完全沉淀;另一份滴加AgNO3溶液,使Cl-完全沉淀。反应中消耗amolH2SO4、bmolAgNO3。则原混合溶液中的c(Na+)为
A. ![]() mol/L B.
mol/L B. ![]() mol/L C.
mol/L C. ![]() mol/L D.
mol/L D. ![]() mol/L
mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各步制取物质,最终无法达到目的的有( )
A. Al![]() Al2O3
Al2O3![]() AlCl3溶液
AlCl3溶液![]() Al2O3
Al2O3
B. Cu![]() CuO
CuO![]() CuSO4溶液
CuSO4溶液![]() CuSO4·5H2O
CuSO4·5H2O
C. Fe ![]() FeCl3
FeCl3 ![]() Fe(OH)3
Fe(OH)3 ![]() Fe2O3
Fe2O3
D. Al2(SO4)3溶液 ![]() Al(OH)3
Al(OH)3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列A、B、C、D是中学常见的混合物分离或提纯的基本装置。

根据混合物分离或提纯的原理,回答在下列实验中需要使用哪种装置。将A、B、C、D填入适当的空格中.
(1)除去Ca(OH)2溶液中悬浮的CaCO3 ______;
(2)从碘水中提取碘______;
(3)用自来水制取蒸馏水______;
(4)分离植物油和水______;
(5)与海水晒盐原理相符的是______.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】据报道,以NaBH4(B为+3价)和H2O2做原料的新型燃料电池可用作深水勘探等无空气环境下的电源,其结构如右图所示.该电池总反应式为:NaBH4+4H2O2=NaBO2+6H2O,下列的说法正确是( )

A. 放电过程中,Na+从右向左迁移
B. a为正极,其电极反应为:BH4--8e-+8OH-=BO2-+6H2O
C. b电极的电极反应式为:H2O2+2e-+2H+=2H2O
D. 每消耗300g、34%的H2O2溶液,理论上流过电路中的电子数为6NA个
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)9.03×1024个H2O分子的物质的量为__________,在标准状况4.48 L SO2的质量为___________。
(2)在标准状况下,22.4L由氮气和氧气组成的混合气体,其质量为30g,则其中氧气的质量为______g。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com