
【题目】不同浓度的硫酸与锌反应时,硫酸可以被还原为SO2,也可被还原为氢气。某校研究性学习小组拟设计下列实验验证这一事实。

(1)该小组设计了如上图所示的实验装置,检查该装置气密性的操作是______________________。
(2)若1.30g锌粒完全溶解,氢氧化钠洗气瓶增重0.64g(烧瓶中残留气体忽略不计,下同),则圆底烧瓶中发生反应的化学方程式为________________________________。
(3)是否使用橡胶管,对实验结果___________(填“有”或“无”) 影响。
【答案】 关闭分液漏斗活塞,向右侧球形管中加入水,一段时间后观察球形管和量气管之间的液面差有无变化(合理即给分) 2Zn+3H2SO4=2ZnSO4+SO2↑+H2↑+2H2O 有
【解析】(1)检验气密性,可关闭分液漏斗活塞,向右侧球形管中加入水,一段时间后观察球形管和量气管之间的液面差有无变化,故答案为:关闭分液漏斗活塞,向右侧球形管中加入水,一段时间后观察球形管和量气管之间的液面差有无变化;
(2)n(Zn)= ![]() =0.02mol,若锌与硫酸只生成二氧化硫气体,则根据Zn+2H2SO4=ZnSO4+SO2↑+2H2O,反应生成的二氧化硫为0.02mol,质量为0.02mol×64g/mol=1.28g,大于氢氧化钠洗气瓶增重0.64 g,说明还生成了氢气且反应生成二氧化硫的锌为0.01mol,生成氢气的锌为0.01mol,则圆底烧瓶中发生反应的化学方程式为2Zn+3H2SO4=2ZnSO4+SO2↑+H2↑+2H2O,故答案为:2Zn+3H2SO4=2ZnSO4+SO2↑+H2↑+2H2O;
=0.02mol,若锌与硫酸只生成二氧化硫气体,则根据Zn+2H2SO4=ZnSO4+SO2↑+2H2O,反应生成的二氧化硫为0.02mol,质量为0.02mol×64g/mol=1.28g,大于氢氧化钠洗气瓶增重0.64 g,说明还生成了氢气且反应生成二氧化硫的锌为0.01mol,生成氢气的锌为0.01mol,则圆底烧瓶中发生反应的化学方程式为2Zn+3H2SO4=2ZnSO4+SO2↑+H2↑+2H2O,故答案为:2Zn+3H2SO4=2ZnSO4+SO2↑+H2↑+2H2O;
(3)使用橡胶管可以平衡气压,保证烧瓶中的压强不变,如果不使用橡胶管,会导致排出的气体体积偏大,对实验结果造成影响,故答案为:有。


 小博士期末闯关100分系列答案
小博士期末闯关100分系列答案 名校名师培优作业本加核心试卷系列答案
名校名师培优作业本加核心试卷系列答案科目:高中化学 来源: 题型:
【题目】已知4NH3+5O2 ![]() 4NO+6H2O(g),若反应速率分别用v(NH3)、v(O2)、v(NO)、v(H2O)[mol·L-1·min-1]表示,则正确的关系是( )
4NO+6H2O(g),若反应速率分别用v(NH3)、v(O2)、v(NO)、v(H2O)[mol·L-1·min-1]表示,则正确的关系是( )
A.![]() v(NH3)=v(O2) B.
v(NH3)=v(O2) B.![]() v(O2)=v(H2O)
v(O2)=v(H2O)
C.![]() v(NH3)=v(H2O) D.
v(NH3)=v(H2O) D.![]() v(O2)=v(NO)
v(O2)=v(NO)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知在25 ℃、1.01×105 Pa下,1mol氢气在氧气中燃烧生成气态水的能量变化如下图所示,下列有关说法正确的是( )
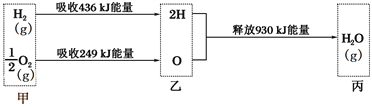
A. H2O分解为H2与O2时放出热量
B. 热化学方程式为:2H2(g) + O2(g) = 2H2O(g) ΔH = -490 kJ·mol-1
C. 甲、乙、丙中物质所具有的总能量大小关系为甲>乙>丙
D. 乙→丙的过程中若生成液态水,释放的能量将小于930 kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮化铝广泛应用于电子陶瓷等工业领域。在一定条件下,AlN可通过以下反应合成:Al2O3+N2+3C![]() 2AlN+3CO。有关该反应下列叙述正确的是
2AlN+3CO。有关该反应下列叙述正确的是
A. AlN中氮的化合价为-3 B. 上述反应中,每消耗1 mol N2需转移3 mol电子
C. AlN的摩尔质量为41 g D. 上述反应中,N2是还原剂,Al2O3是氧化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设C+CO2==2CO-Q1,反应速率为v1;N2+3H2==2NH3+Q2,反应速率为v2,对于上述反应,当温度升高时,v1和v2的变化情况为
A.同时减小B.同时增大C.v1增大,v2减小D.v1减小,v2增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锌及其化合物用途广泛。回答下列问题
(1)火法炼锌以闪锌矿(主要成分是ZnS) 为主要原料,涉及的主要反应有:
2ZnS(s)+3O2(g)=2ZnO(s)+2SO2(g) △H1=-930kJ·mol-1
C(s)+O2(g)=CO2(g) △H2=-393.5 kJ·mol-1
C(s)+CO2(g)=2CO(g) △H3= +172.5 kJ·mol-1
ZnO(s)+CO(g)=Zn(g)+CO2(g)△H4= +198 kJ·mol-1
反应ZnS(s)+tC(s)+2O2(g)=Zn(g)+CO2(g)+SO2(g)的△H =_________kJ·mol-1
(2)银锌蓄电池工作原理为Ag2O2+2Zn+2H2O![]() 2Ag +2Zn(OH)2,该蓄电池充电时,发生还原反应的物质是__________, 正极反应分为两个阶段,第二阶段为Ag2O+H2O+2e-= 2Ag+2OH-,写 出第一阶 段 正极 电极反应式_____________________________。
2Ag +2Zn(OH)2,该蓄电池充电时,发生还原反应的物质是__________, 正极反应分为两个阶段,第二阶段为Ag2O+H2O+2e-= 2Ag+2OH-,写 出第一阶 段 正极 电极反应式_____________________________。
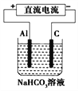
(3)以(2)中蓄电池作电源,用如图所示的装置在实验室模拟铝制品表面“钝化”处理的过程中,发现溶液逐渐变浑浊,原因是__________________(用相关的电极反应式和离子方程式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在T℃时,发生反应C(s)+H2O(g)![]() CO(g)+H2(g)
CO(g)+H2(g)
(1)恒温时,在一个2L的密闭容器中加入4molC 和1molH2O(g),5min后反应达到平衡,C 的转化率为20%。
①0~5min 内,用H2O(g)表示的平均反应速率为_________。
②有关该反应下列说法正确的是_________。
a.容器中压强不变或混合气体密度不变均可以判定该反应已经达到平衡状态
b.若将加入的碳块改为碳粉,则能够提高水蒸气的平衡转化率
c.平衡后,再加入0 .5molC、5mol H2O(g)、2molCO、2molH2,平衡不移动
(2)已知:Ⅰ.破坏1mol 共价键所需要的能量如下表:
共价键 | 石墨中的碳碳键 | H-H | C | H-O |
能量/kJ | 475.7 | 436 | 1072 | 463 |
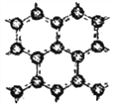
Ⅱ.石墨层由六角形蜂巢结构的碳原子构成,如右图所示,已知每个碳原子形成的共价键数为1.5NA。
某同学构想:通过下图所示装置实现C(s)+H2O(g)![]() CO(g)+H2(g)的反应。
CO(g)+H2(g)的反应。
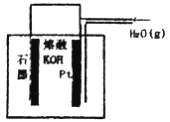
①按该考生的构想,石墨电极发生的反应式为_______________________。
②请用计算判断该构想的合理性:______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,有c(CH3COOH)+c(CH3COO-)=0.1mol/L的一组CH3COOH、CH3COONa的混合溶液,溶液中c(CH3COOH)、c(CH3COO-)与pH的关系如图所示.下列有关溶液中离子浓度关系的叙述正确的是( )

A. pH=3.5的溶液中:c(Na+)+c(H+)-c(OH-)+c(CH3COOH)=0.1mol/L
B. pH=5.5的溶液中:c(CH3COOH)>c(CH3COO-)>c(H+)>c(OH-)
C. W点所表示的溶液中:c(H+)=c(CH3COOH)+c(OH-)
D. 向W点所表示的1.0L溶液中通入0.05molHCl气体(溶液体积变化可忽略):c(H+)=c(CH3COOH)+c(OH-)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com