
【题目】下列反应中,一定不属于氧化还原反应的是( )
A. 分解反应 B. 化合反应 C. 置换反应 D. 复分解反应
 数学奥赛暑假天天练南京大学出版社系列答案
数学奥赛暑假天天练南京大学出版社系列答案 南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案
南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案科目:高中化学 来源: 题型:
【题目】高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压。高铁电池的总反应为:![]() 下列叙述错误的是
下列叙述错误的是
A. 放电时正极附近溶液的碱性增强
B. 充电时锌极与外电源正极相连
C. 放电时每转移3 mol电子,正极有1mol K2FeO4被还原
D. 充电时阳极反应为:Fe(OH)3 - 3e- + 5OH- FeO42- + 4 H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,将气体X和气体Y 各0.16 mol充入10 L 恒容密闭容器中,发生反应X(g)+ Y(g)![]() 2Z(g) △H < 0,一段时间后达到平衡。反应过程中测定的数据如下表。下列说法正确的是 ( )
2Z(g) △H < 0,一段时间后达到平衡。反应过程中测定的数据如下表。下列说法正确的是 ( )
t / min | 2 | 4 | 7 | 9 |
n(Y)/mol | 0.12 | 0.11 | 0.10 | 0.10 |
A. 反应前2min的平均速率v(Z)=2.0×10-5mol/(L·min)
B. 其他条件不变,降低温度,反应达到新平衡前v(逆)>v(正)
C. 该温度下此反应的平衡常数K=1.44
D. 其他条件不变,再充入0.2 mol Z,平衡时X的体积分数增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为探究外界条件对反应:mA(g)+nB(g)cZ(g)△H的影响,以A和B物质的量之比为m:n开始反应,通过实验得到不同条件下达到平衡时Z的物质的量分数.实验结果如图所示,下列判断正确的是( )
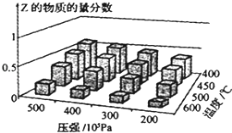
A.△H>0
B.升温,正、逆反应速率都增大,平衡常数减小
C.增大压强,Z的含量减小
D.在恒温恒容下,向已达到平衡的体系中加入少量Z,达到平衡后Z的含量减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,某未知溶液中![]() =1×1012,且含有大量Al3+和NO3﹣,检验此溶液中是否大量存在以下6种离子:①SiO32﹣、②NH4+、③Fe2+、④Na+、⑤HCO3﹣、⑥Cl﹣,其中不必检 验就能加以否定的离子是 ( )
=1×1012,且含有大量Al3+和NO3﹣,检验此溶液中是否大量存在以下6种离子:①SiO32﹣、②NH4+、③Fe2+、④Na+、⑤HCO3﹣、⑥Cl﹣,其中不必检 验就能加以否定的离子是 ( )
A.①③⑤ B.②③④ C.①②⑥ D.④⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙炔是一种重要的有机化工原料,以乙炔为原料在不同的反应条件下可以转化成以下化合物。
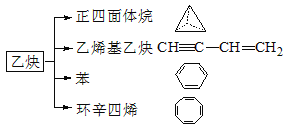
完成下列各题:
(1)实验室制取乙炔的化学反应方程式是____________________。
(2)正四面体烷的分子式为___________,其二氯取代产物有__________种。
(3)关于乙烯基乙炔分子的说法正确的是__________(双选)。
A.由乙炔通过取代反应制得
B.能使酸性KMnO4溶液褪色
C.1 mol乙烯基乙炔能与3 mol Br2发生加成反应
D.等物质的量的乙炔与乙烯基乙炔完全燃烧时的耗氧量相同
(4)写出与环辛四烯互为同分异构体且属于芳香烃的分子的结构简式: _____ _____ _。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关二氧化硫的说法正确的是( )
A. 密度比空气小
B. 是无色无味的气体
C. SO2能使溴水褪色,说明SO2具有漂白性
D. 某生产硫酸厂区紫罗兰花变成白色,说明其周围空气中可能含较高浓度SO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、Q、R是五种短周期元素,原子序数依次增大。X、Y两元素最高正价与最低负价之和均为0;Q与X同主族;Z、R分别是地壳中含量最高的非金属元素和金属元素。 请回答下列问题:
(1)五种元素原子半径由大到小的顺序是(写元素符号)________________。
(2)X与Y能形成多种化合物,其中相对分子质量最小的分子中只含有_________键(填“离子”、“极性”或“非极性”)。
(3)由以上某些元素组成的化合物A、B、C、D有如下转化关系:![]() (在水溶液中进行)其中,C是溶于水显酸性的气体;D是淡黄色固体。
(在水溶液中进行)其中,C是溶于水显酸性的气体;D是淡黄色固体。
写出C的结构式:________;D的电子式:________。
①如果A、B均由三种元素组成,B为两性不溶物,由A转化为B的离子方程式为________________。
②如果A由三种元素组成,B由四种元素组成,A、B溶液均显碱性。由A转化为B的离子方程式为___________________。(提示:强酸弱碱盐显酸性,强碱弱酸显碱性)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求回答下列问题:
(1)配制FeCl3溶液时,需将固体溶于较浓的盐酸后按需要进行稀释,用离子方程式解释其原因 。
(2)用离子方程式表示出泡沫灭火器的原理 。
(3)实验室中常用NaOH溶液来进行洗气和提纯,当100mL 3mol·L-1的NaOH溶液吸收标准状况下4.48LCO2时,所得溶液中离子浓度由大到小的顺序为 。
(4)常温下,浓度均为0.1mol/L的下列五种溶液的PH值如下表所示:
溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN |
pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 |
①根据表中数据,将浓度均为0.01mol· L-1的下列四种酸的溶液分别稀释100倍,pH变化最小的是 。
A.HCN B.HClO C.H2CO3 D.CH3COOH
②根据以上数据,判断下列反应可以成立的是 。
A.CH3COOH+Na2CO3═NaHCO3+CH3COONa
B.CH3COOH+NaCN═CH3COONa+HCN
C.CO2+H2O+2NaClO═Na2CO3+2HClO
D.NaHCO3+HCN═NaCN+H2O+CO2
(5)已知在Cu2+、Mg2+、Fe2+浓度相同的溶液中,其开始沉淀时的pH如下:
离子 | Fe2+ | Cu2+ | Mg2+ |
pH | 7.6 | 5.2 | 10.4 |
若向该溶液中滴加NaOH溶液,则先沉淀的是 (填离子符号),
判断Ksp[Fe(OH)2] Ksp[Mg(OH)2](填“>”、“=”或“<”)。
已知Ksp[Cu(OH)2]=2.5×10-20,若向该溶液中加入生石灰调节其pH,当pH= 时,溶液中Cu2+沉淀完全。[已知1g2=0.3]
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com