
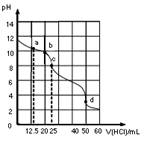
| A.a点:c(CO32-)=c(HCO3-)>c(OH-) |
| B.b点:5c(Cl-)>4c(HCO3-)+4c(CO32-) |
| C.c点:c(OH-)=c(H+)+c(HCO3-)+2c(H2CO3) |
| D.d点:c(H+)=c(CO32-)+c(HCO3-)+c(OH-) |


科目:高中化学 来源:不详 题型:单选题
| A.①⑤ | B.③④ | C.②⑤ | D.②④ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.c(H+)=1×10-7mol·L-1的溶液 |
| B.c(H+)=c(OH-)=1×10-6mol·L-1的溶液 |
| C.pH=14-pOH的溶液 [注pOH=-lg c(OH-)] |
| D.由等体积、等物质的量浓度的一元酸溶液与NaOH溶液混合后所形成的溶液 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| 温度 / ℃ | 25 | t1 | t2 |
| 水的离子积常数 | 1×10-14 | α | 1×10-12 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
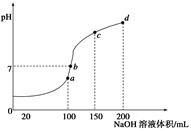
| | I1 | I2 | I3 | I4 |
| 电离能(kJ/mol) | 578 | 1817 | 2745 | 11578 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.将pH=4的某酸稀释10倍,测得其pH<5,则该酸为弱酸 |
B.0.1mol 的NaHCO3溶液中 的NaHCO3溶液中 |
C.0.1mol 的NaHA溶液Ph=5,则溶液: 的NaHA溶液Ph=5,则溶液: |
D.pH=4的醋酸与pH=10的氢氧化钠溶液等体积混合,所得溶液 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.二氧化碳与超临界水作用生成汽油的反应,属于放热反应 |
| B.“水热反应”是一种复杂的物理化学变化 |
| C.火力发电厂可望利用废热,将二氧化碳转变为能源物质 |
| D.随着科技的进步,“水热反应”制取能源有望实现地球上碳资源的和谐循环 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.2 | B.3 | C.12 | D.14 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
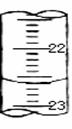
| 滴定次数 | 待测液体积(mL) | 标准盐酸体积(mL) | |
| 滴定前读数(mL) | 滴定后读数(mL) | ||
| 第一次 | 20.00 | 0.50 | 22.60 |
| 第二次 | 20.00 | 1.00 | 24.50 |
| 第三次 | 20.00 | 2.10 | 24.00 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com