
【题目】我国土地面积的1/5受到重金属的污染。镉盐因溶解度高,在水中多以离子状态存在,对水生植物的影响尤为严重。某科研小组研究不同浓度的锅对水生植物紫萍生理的影响,结果见图。对实验数据分析时发现MDA(膜脂分解最重要的产物之一)的含量与镉浓度呈正相关。请回答下列问题。
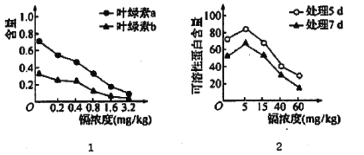
(1)由图I可知,该实验的自变量为____,由图I得出的结论是________________。
(2)可溶性蛋白含量是衡量植物总体代谢的重要指标。生物学上可以用______试剂检测可溶性蛋白,会产生________色的络合物。
(3)由MDA含量与镉浓度的关系可推测:镉可能是通过破坏______(结构)影响________反应阶段,降低光合速率;同时也可能通过破坏______(结构)影响有氧呼吸第三阶段的进行。
【答案】镉的浓度;随着镉浓度的增大,叶绿素的含量逐渐降低 叶绿素a受影响的幅度更大 双缩脲 紫 类囊体薄膜(或基粒) 光 线粒体内膜
【解析】
根据题干信息和图分析可知,该实验的目的是研究不同浓度的镉对水生植物紫萍生理的影响,实验的自变量为镉的浓度和处理时间,因变量是叶绿素a和b的含量、可溶性蛋白的含量。分析试验数据发现:随着镉浓度的增大,叶绿素的含量逐渐降低,叶绿素a受影响的幅度更大;随着镉浓度的增大,可溶性蛋白的含量先增加后降低,且相同镉浓度下,处理5d的可溶性蛋白含量较高。
(1)据图分析可知,该实验研究不同浓度的镉对水生植物紫萍生理的影响,实验的自变量为镉的浓度和处理时间;分析试验数据发现随着镉浓度的增大,叶绿素的含量逐渐降低,叶绿素a受影响的幅度更大。
(2)生物学生可以用双缩脲试剂检测蛋白质,会产生紫色络合物。
(3)光合作用的光反应场所是叶绿体类囊体的薄膜;呼吸作用的第三阶段的场所是线粒体内膜。


科目:高中化学 来源: 题型:
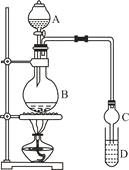
【题目】乙酸乙酯是一种用途广泛的精细化工产品。某课外小组设计实验室制取并提纯乙酸乙酯的方案如下:
已知:①氯化钙可与乙醇形成CaCl2·6C2H5OH
②有关有机物的沸点:
试剂 | 乙醚 | 乙醇 | 乙酸 | 乙酸乙酯 |
沸点/℃ | 34.7 | 78.5 | 118 | 77.1 |
③2CH3CH2OH![]() CH3CH2OCH2CH3+H2O
CH3CH2OCH2CH3+H2O
I.制备过程
装置如图所示,A中放有浓硫酸,B中放有9.5mL无水乙醇和6mL冰醋酸,D中放有饱和碳酸钠溶液。
(1)写出乙酸与乙醇发生酯化反应的化学方程式 。
(2)实验过程中滴加大约3mL浓硫酸,B的容积最合适的是 (填入正确选项前的字母)
A.25mL B.50mL C.250mL D.500mL
(3)球形干燥管的主要作用是 。
(4)预先向饱和Na2CO3溶液中滴加几滴酚酞试液,目的是
。
Ⅱ.提纯方法:①将D中混合液转入分液漏斗进行分液。
②有机层用5mL饱和食盐水洗涤,再用5mL饱和氯化钙溶液洗涤,最后用水洗涤。有机层倒入一干燥的烧瓶中,用无水硫酸镁干燥,得粗产物。
③将粗产物蒸馏,收集77.1℃的馏分,得到纯净干燥的乙酸乙酯。
(5)第①步分液时,选用的两种玻璃仪器的名称分别是 、 。
(6)第②步中用饱和食盐水、饱和氯化钙溶液、最后用水洗涤,分别主要洗去粗产品中的 , , 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将SO2分别通入无氧、有氧的浓度均为0.1 mol·L-1的 BaCl2溶液和Ba(NO3)2溶液中,探究体系中微粒间的相互作用,实验记录如下:
实验记录 | |
pH变化 |
|
溶液中是否产生沉淀 | BaCl2溶液(无氧)中无白色沉淀、BaCl2溶液(有氧)中有白色沉淀 Ba(NO3)2溶液(无氧)中有白色沉淀、Ba(NO3)2溶液(有氧)中有白色沉淀 |
下列说法不正确的是
A.曲线a 所示溶液pH降低的原因:SO2 + H2O![]() H2SO3
H2SO3![]() H+ + HSO3-
H+ + HSO3-
B.曲线c 所示溶液中发生反应:2Ba2+ + O2 + 2SO2 + 2H2O =2BaSO4↓+ 4H+
C.与曲线a、b、c对比,可知曲线d所表示的过程中NO3-是氧化SO2的主要微粒
D.依据该实验预测0.2 mol·L-1的KNO3溶液(无氧)也可以氧化SO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Li4Ti5O12和LiFePO4都是锂离子电池的电极材料,可利用钛铁矿(主要成分为FeTiO3,还含有少量MgO、SiO2等杂质)来制备,工艺流程如下:

回答下列问题:
(1)Li2Ti5O15中Ti的化合价为+4,其中过氧键的数目为__________________。
(2)酸浸后,钛主要以TOCl42-形式存在,写出相应反应的离子方程式_________________。
(3)甲组同学取2 mL FeCl2溶液,加入几滴氯水,再加入1滴KSCN溶液,溶液变红,说明Cl2可将Fe2+氧化。FeCl2溶液与氯水反应的离子方程式为_________________________________________
丁组同学向盛有H2O2溶液的试管中加入几滴酸化的FeCl2溶液,溶液变成棕黄色,发生反应的离子方程式为____________;
(4)+6价铬的化合物毒性较大,常用NaHSO3将废液中的Cr2O72-还原成Cr3+,反应的离子方程式为___________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有下列4种物质:①NO2②Al(OH)3③FeCl2④SiO2
(1)与水反应产生无色气体的是___(填序号,下同),反应的化学方程式为___。
(2)光导纤维的主要成分是___。
(3)既能与酸反应又能与强碱溶液反应的两性氢氧化物是___,该物质与强碱反应的离子方程式为___。
(4)有人预测①与③的溶液能发生化学反应,可能出现的现象是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关化学用语使用正确的是
A. HC1的电子式:![]() B. CO2的比例模型:
B. CO2的比例模型: ![]()
C. 乙酸的分子式:CH3COOH D. 甲烷的实验式为CH4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学为制取乙酸乙酯,在试管a中加入3ml乙醇,然后边振荡试管边慢慢加入2ml浓硫酸和2ml乙酸,按下图所示连接好装置进行实验。请回答:
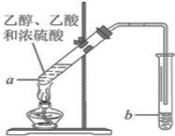
(1)试管b中盛放的溶液是_________________;
(2)实验完成后,试管b的页面上有透明的不溶于水的油状液体产生。若分离该液体混合物需要用到的玻璃仪器是______;
(3)乙醇和乙酸反应生成乙酸乙酯的反应类型是___________;
(4)在制取乙酸乙酯中,有关浓硫酸的作用说法错误的是_______________;
A.催化剂 B.吸水剂 C.脱水剂 D.提高反应速率
(5)试管b中溶液的作用是_______________;
(6)乙酸在酯化反应中断键方式是在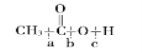 的__________处。
的__________处。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)氢氧燃料电池是符合绿色化学理念的新型发电装置。下图为电池示意图,该电池电极表面镀一层细小的铂粉,铂吸附气体的能力强,性质稳定。其正极反应方程式为____________,若将负极材料改为CH4,写出其负极反应方程式___________。
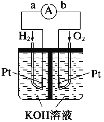
(2)NH3代替氢气研发燃料电池是当前科研的一个热点。使用的电解质溶液是2 mol·L-1的KOH溶液,电池总反应为:4NH3+3O2=2N2+6H2O。该电池负极的电极反应式为__________;每消耗3.4g NH3转移的电子数目为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“太阳水”电池装置如图所示,该电池由三个电极组成,其中a为TiO2电极,b为Pt电极,c为WO3电极,电解质溶液为pH=3的Li2SO4-H2SO4溶液。锂离子交换膜将电池分为A、B两个区,A区与大 气相通,B区为封闭体系并有N2保护。下列关于该电池的说法错误的是( )
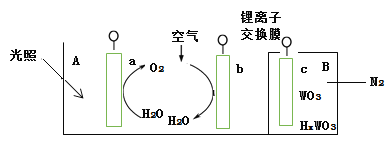
A.若用导线连接a、c,则a为负极,该电极附近pH减小
B.若用导线连接a、c,则c电极的电极反应式为HxWO3 - xe- =WO3 + xH+
C.若用导线先连接a、c,再连接b、c,可实现太阳能向电能转化
D.若用导线连接b、c, b电极的电极反应式为O2+4H++4e-=2H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com