
【题目】现有下列4种物质:①NO2②Al(OH)3③FeCl2④SiO2
(1)与水反应产生无色气体的是___(填序号,下同),反应的化学方程式为___。
(2)光导纤维的主要成分是___。
(3)既能与酸反应又能与强碱溶液反应的两性氢氧化物是___,该物质与强碱反应的离子方程式为___。
(4)有人预测①与③的溶液能发生化学反应,可能出现的现象是___。
【答案】① 3NO2+H2O=2HNO3+NO ④ ② Al(OH)3+OH-=AlO![]() +2H2O 溶液由浅绿色变为棕黄色;红棕色气体变无色;反应后气体与空气接触变红棕色
+2H2O 溶液由浅绿色变为棕黄色;红棕色气体变无色;反应后气体与空气接触变红棕色
【解析】
(1)NO2与水反应生成HNO3和NO,与水反应产生无色气体的是①,反应的化学方程式为3NO2+H2O=2HNO3+NO。故答案为:①;3NO2+H2O=2HNO3+NO;
(2)光导纤维的主要成分是SiO2。故答案为:④;
(3)既能与酸反应又能与强碱溶液反应的两性氢氧化物是Al(OH)3,Al(OH)3与强碱反应生成偏铝酸根和水,离子方程式为Al(OH)3+OH-=AlO![]() +2H2O。故答案为:②;Al(OH)3+OH-=AlO
+2H2O。故答案为:②;Al(OH)3+OH-=AlO![]() +2H2O;
+2H2O;
(4)①NO2和③FeCl2的溶液能发生化学反应,二氧化氮能将亚铁离子氧化成铁离子、自身被还原成NO,NO在空气中又被氧化成NO2,可能出现的现象是溶液由浅绿色变为棕黄色;红棕色气体变无色;反应后气体与空气接触变红棕色。故答案为:溶液由浅绿色变为棕黄色;红棕色气体变无色;反应后气体与空气接触变红棕色。


 智能训练练测考系列答案
智能训练练测考系列答案科目:高中化学 来源: 题型:
【题目】两种烃的衍生物A和B,所含碳、氢、氧的质量比均为6∶1∶4。完全燃烧0.1 mol A能生成3.6 g水。B只含一个醛基,1.1g B与足量银氨溶液反应,可析出2.7 g Ag。则下列关于物质A和物质B的判断正确的是
A. 物质A一定是乙醛
B. 物质A和物质B互为同分异构体
C. 物质B的同分异构体中既含有醛基又含有羟基的有6种
D. 物质B属于酯类的同分异构体有4种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】阿伏加德罗常数的值为![]() 。下列说法正确的是
。下列说法正确的是
A. 1L0.1mol·![]() NH4Cl溶液中,
NH4Cl溶液中, ![]() 的数量为0.1
的数量为0.1![]()
B. 2.4gMg与H2SO4完全反应,转移的电子数为0.1![]()
C. 标准状况下,2.24LN2和O2的混合气体中分子数为0.2![]()
D. 0.1mol H2和0.1mol I2于密闭容器中充分反应后,其分子总数为0.2![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列指定反应的离子方程式正确的是( )
A. 氯气溶于水:Cl2+H2O=2H++Cl-+ClO-
B. Na2CO3溶液中CO32-的水解:CO32-+H2O=HCO3-+OH-
C. 酸性溶液中KIO3与KI反应生成I2:IO3-+I-+6H+=I2+3H2O
D. NaHCO3溶液中加足量Ba(OH)2溶液:HCO3-+Ba2++OH-=BaCO3↓+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组对菠菜中的铁元素(主要以难溶的FeC2O4形式存在)进行检测。实验如下:
I.水煮检验法:
II灼烧检验法: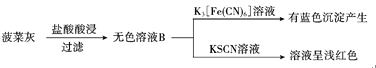
(1)CCl4的作用为______。
(2)操作i中起分离作用的仪器名称为______。
(3)溶液A中未能检测出Fe2+的可能原因是______。
(4)取无色溶液B,先滴加H2O2溶液,再滴加KSCN溶液,溶液呈红色。用离子方程式表示H2O2的作用:______。
(5)甲同学取少量无色溶液B,滴加酸性KMnO4溶液,振荡后,溶液紫色消失,因此得出结论,溶液B含有Fe2+。乙同学认为甲同学的实验方法不严谨,设计并完成如下实验:用稀硝酸溶解菠菜灰,产生的无色气体使澄清石灰水变浑浊,得到的无色溶液中滴加AgNO3溶液,产生白色沉淀(Ag2C2O4)。甲同学反思自己的方法不严谨,理由是_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国土地面积的1/5受到重金属的污染。镉盐因溶解度高,在水中多以离子状态存在,对水生植物的影响尤为严重。某科研小组研究不同浓度的锅对水生植物紫萍生理的影响,结果见图。对实验数据分析时发现MDA(膜脂分解最重要的产物之一)的含量与镉浓度呈正相关。请回答下列问题。
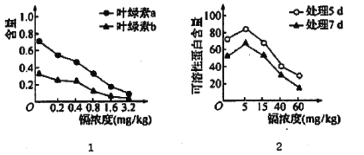
(1)由图I可知,该实验的自变量为____,由图I得出的结论是________________。
(2)可溶性蛋白含量是衡量植物总体代谢的重要指标。生物学上可以用______试剂检测可溶性蛋白,会产生________色的络合物。
(3)由MDA含量与镉浓度的关系可推测:镉可能是通过破坏______(结构)影响________反应阶段,降低光合速率;同时也可能通过破坏______(结构)影响有氧呼吸第三阶段的进行。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】相对分子质量约为4000的聚乙二醇具有良好的水溶性,是一种缓泻剂。聚乙二醇可由环氧乙烷在酸性条件下聚合而成(![]() )。下列说法正确的是
)。下列说法正确的是
A.环氧乙烷在酸性条件下发生加聚反应制得聚乙二醇
B.聚乙二醇的结构简式为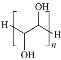
C.相对分子质量约为4000的聚乙二醇的聚合度n≈67
D.聚乙二醇能保持肠道水分的原因是其可和H2O分子间形成氢键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】温度为T1时,向容积为2 L 的密闭容器甲、乙中分别充入一定量的CO(g)和H2O(g),发生反应:CO(g) + H2O(g) ![]() CO2(g) + H2(g) H = -41 kJ/mol。数据如下,下列说法不正确的是
CO2(g) + H2(g) H = -41 kJ/mol。数据如下,下列说法不正确的是
容器 | 甲 | 乙 | ||
反应物 | CO | H2O | CO | H2O |
起始时物质的量(mol) | 1.2 | 0.6 | 2.4 | 1.2 |
平衡时物质的量(mol) | 0.8 | 0.2 | a | b |
A. 甲容器中,平衡时,反应放出的热量为16.4 kJ
B. T1时,反应的平衡常数K甲 = 1
C. 平衡时,乙中CO的浓度是甲中的2倍
D. 乙容器中,平衡时CO的转化率约为75%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E均是短周期元素,其原子序数依次增大,A和B同周期,A和D同主族,A原子最外层电子数是内层电子数的二倍,B元素族序数是周期数的三倍,B的阴离子与C的阳离子电子层结构相同,C的单质与B的单质在不同条件下反应,可生成C2B或C2B2,E是所在周期中原子半径最小的元素。请回答:
(1)D在元素周期表中的位置是 。
(2)C2B的电子式是 ;AB2的结构式是 。
(3)B、C、E的离子半径由大到小的顺序为 (用化学式回答,下同);A、D、E元素最高价氧化物对应水化物的酸性由强到弱为 。
(4)B的气态氢化物与H2S相比沸点高的是 (用化学式回答);原因是 。
(5)水中锰含量超标,容易使洁具和衣物染色,使水产生异味,EB2可以用来除去水中超标的Mn2+,生成黑色沉淀MnO2,当消耗13.50gEB2时,共转移了1mol电子,则反应的离子方程式: 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com