
【题目】氯苯的合成工艺分为液相法和气相法两种,实验室模拟液相法的装置如下图(其中夹持仪器、加热装置及尾气处理装置已略去),有关物质的性质如表所示
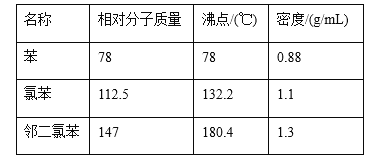
回答下列问题:
(1)A反应器是利用实验室法制取氯气,装置中中空导管B的作用是_______________。
(2)把干燥的氯气通入装有50.0mL干燥苯、少量铁屑的三颈烧瓶C中制备氯苯,写出本方法制备氯苯的化学方程式_____________。
(3)C的反应温度不宜过高,原因为①温度过高,反应得到二氯苯;②_______,D出口的主要尾气成分有___________________。
(4)提纯粗产品过程如下:
![]()
净化过程中加入无水CaCl2的目的是_____________。
(5)实验中最终得到产品22.5mL,产率为______________。
(6)气相法制氯苯是将空气、氯化氢气体混合物与苯在温度为210℃,迪肯型催化剂(CuCl2、FeCl3附在三氧化铝上)存在下进行氯化,发生反应生成氯苯。其反应方程式为:_______________。
【答案】平衡气压 ![]() +Cl2
+Cl2![]() +HCl 温度过高,苯挥发,原料利用率不高 Cl2、HCl、苯蒸气 吸水干燥 39% 2
+HCl 温度过高,苯挥发,原料利用率不高 Cl2、HCl、苯蒸气 吸水干燥 39% 2![]() + 2HCl + O2
+ 2HCl + O2![]() 2
2![]() +2H2O
+2H2O
【解析】
(1)玻璃管B伸入液面下,装置内压强过大时,液体进入玻璃管;
(2)在铁粉作催化剂的条件下,苯与氯气发生取代反应生成氯苯和氯化氢;
(3)苯的沸点低,易挥发;
(4)无水CaCl2具有吸水性,是常用的干燥剂;
(5)产品的产率=氯苯的实际产量÷理论产量×100%;
(6)氧气、氯化氢气体混合物与苯在温度为210℃、催化剂存在下进行氯化,生成氯苯、水。
(1)玻璃管B伸入液面下,装置内压强过大时,液体进入玻璃管,可以用于平衡气压;
(2)在铁粉作催化剂的条件下,苯与氯气发生取代反应生成氯苯和氯化氢,反应方程式是![]() +Cl2
+Cl2![]() +HCl;
+HCl;
(3)C的反应温度不宜过高,原因为①温度过高,反应得到二氯苯;②温度过高,苯挥发,原料利用率不高;苯易挥发,反应产生HCl气体,且有未反应的氯气,所以D出口气体中含有HCl、苯蒸汽、氯气;
(4)无水CaCl2具有吸水性,是常用的干燥剂,净化过程中加入无水CaCl2的目的是吸水干燥氯苯;
(5)50.0mL干燥苯的物质的量是![]() 0.56mol,理论上生成氯苯的物质的量是0.56mol; 最终得到氯苯22.5mL,实际生成氯苯的物质的量是
0.56mol,理论上生成氯苯的物质的量是0.56mol; 最终得到氯苯22.5mL,实际生成氯苯的物质的量是![]() ,产品的产率=0.22mol÷0.56mol×100%=39%。
,产品的产率=0.22mol÷0.56mol×100%=39%。
(6)氧气、氯化氢气体混合物与苯在温度为210℃、催化剂存在下进行氯化,生成氯苯、水,反应方程式是2![]() + 2HCl + O2
+ 2HCl + O2![]() 2
2![]() +2H2O。
+2H2O。


科目:高中化学 来源: 题型:
【题目】反应:2A(g)+3B(g)![]() C(g)+4D(g),速率最快的是( )
C(g)+4D(g),速率最快的是( )
A. v(C)=0.1mol·L-1·s-1 B. v(B)=4.0 mol·L-1·min-1
C. v(A)=2.0mol·L-1·min-1 D. v(D)=0.3mol·L-1·s-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】维生素P的结构如图所示,其中R为烷烃基。下列关于维生素P的叙述正确的是
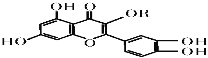
A.分子中的官能团有羟基、碳碳双键、醚键、酯基
B.若R为甲基,则该物质的分子式可以表示为C16H12O7
C.1 mol该化合物最多可消耗NaOH 为5mol
D.1 mol该化合物最多消耗溴水中的溴5 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁的某种氧化物20 g,在加热的条件下通入足量的CO完全反应,将生成的气体用石灰水吸收,得到沉淀37.5 g,求该氧化物中铁元素与氧元素的质量比。_________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请按要求填空:
(1)写出![]() 中含氧官能团的名称_______________;
中含氧官能团的名称_______________;
(2)![]() 属于__________类化合物;
属于__________类化合物;
(3)CH2=CH—CH3在催化剂加热条件下生成聚合物的反应方程式为________;
(4)写出实验室制乙炔的化学反应方程式_________________;
(5)①称取3.4g某有机化合物A,完全燃烧后生成1.8g H2O和8.8g CO2,已知该有机物的蒸气对氢气的相对密度为68,则该有机物的分子式为_________________;
②该有机物A的核磁共振氢谱和红外光谱如下:

试推测有机物A的结构简式为_________________________;
③与A属于同类有机物的同分异构体包括A共有_________种。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.在一定条件下,可逆反应A+B![]() mC变化如图所示。已知纵坐标表示在不同温度和压强下生成物C在混合物中的质量分数,p为反应在T2温度时达到平衡后向容器加压的变化情况,问:
mC变化如图所示。已知纵坐标表示在不同温度和压强下生成物C在混合物中的质量分数,p为反应在T2温度时达到平衡后向容器加压的变化情况,问:

(1)温度T1________T2(填“大于”“等于”或“小于”)。
(2)正反应是________反应(填“吸热”或“放热”)。
(3)如果A、B、C均为气体,则m________2(填“大于”“等于”或“小于”)。
(4)当温度和容积不变时,如在平衡体系中加入一定量的某稀有气体,则体系的压强________(填“增大”“减小”或“不变”),平衡________移动(填“向正反应方向”“向逆反应方向”或“不”)。
II.合成氨工业中氢气可由天然气和水蒸汽反应制备,其主要反应为:CH4+2H2O=CO2+4H2。
已知:CH4(g)+2O2(g)═CO2(g)+2H2O(l) △H =﹣890 kJ/mol
2H2(g)+O2(g)═2H2O(l) △H =﹣571.6 kJ/mol
H2O(g)=H2O(l) △H =﹣44 kJ/mol
写出由天然气和水蒸汽反应制备H2的热化学方程式:_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,水溶液中![]() 和
和![]() 的浓度变化曲线如图所示,下列说法正确的是
的浓度变化曲线如图所示,下列说法正确的是![]()

A.升高温度,可能引起由a向b的变化
B.该温度下,水的离子积常数为![]()
C.该温度下,向水中加入![]() 固体可能引起由b向a的变化
固体可能引起由b向a的变化
D.稀释该温度下某溶液可引起由b向c的变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水是生命之源,与我们的生活密切相关。在化学实验和科学研究中,水也是一种常用的试剂。
(1)H2O水分子的VSEPR模型为_______形,氧原子的杂化方式为_____
(2)水分子在特定条件下容易得到一个H+,形成水合氢离子(H3O+),用电子式表示它的形成过程为___________________________,
(3)对于(2)中涉及的变化过程的描述不合理的是________。
a.氧原子的杂化类型发生了改变 b.微粒的形状发生了改变
c.微粒的化学性质发生了改变 d.微粒中的键角发生了改变
(4)在冰晶体中,每个水分子与相邻的4个水分子形成氢键(如图所示),已知冰的升华热是51 kJ/mol,除氢键外,水分子间还存在范德华力(11 kJ/mol),则冰晶体中氢键的“键能”是_________kJ/mol(设气态水中无氢键)。
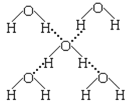
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.300℃时将2molA和2molB两种气体混合于2L密闭容器中,发生如下反应:3A(g)+B(g)2C(g)+2D(g) △H,2min末达到平衡,生成0.8moLD。
(1)300℃时,该反应的平衡常数表达式为K=________,已知K300℃<K350℃,则△H________(填“>”或“<” 0).
(2)在2min末时,B的平衡浓度为________,D的平均反应速率为________。
(3)若温度不变,缩小容器容积,则A的转化率________![]() 填“增大”“减小”或“不变”
填“增大”“减小”或“不变”![]() 。
。
II.在一定条件下,可逆反应:mA+nBpC达到平衡,若:
(1)A、B、C都是气体,减小压强,平衡向正反应方向移动,则,m+n________(填“>”“<”或“![]() ” p)。
” p)。
(2)A、C是气体,而且m+n=p,增大压强可使平衡发生移动,则平衡移动的方向是________。
(3)加热后,可使C的质量增加,则正反应是________(填“放热”或“吸热”)反应。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com