
| A. | 分子的极性 | B. | 分子的对称性 | C. | 分子的空间构型 | D. | 化学键的极性 |
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
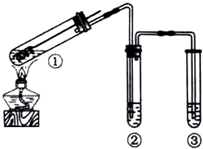
| A. | 为确认CuSO4生成,向①中加水,观察颜色 | |
| B. | 上下移动①中铜丝可控制SO2的量 | |
| C. | ②中选用品红溶液验证SO2的生成 | |
| D. | ③中选用NaOH溶液吸收多余的SO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该物质属于两性氢氧化物 | |
| B. | 该药剂不适合于胃溃疡患者服用 | |
| C. | 1mol NaAl(OH)2CO3最多可消耗3molH+ | |
| D. | 该物质是Al(OH)3和Na2CO3的混合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 基态原子含有未成对电子最多的第二周期元素 | |
| B. | 某激发态为1s22s12p3的原子 | |
| C. | 基态原子最外层电子排布为2s22p6的元素 | |
| D. | 基态原子最外层电子排布为3s23p5的元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
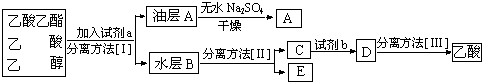
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江西省高二上10月月考化学试卷(解析版) 题型:选择题
一定条件下反应2AB(g) 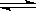 A2(g)+B2(g)达到平衡状态的标志是( )
A2(g)+B2(g)达到平衡状态的标志是( )
A.单位时间内生成 nmolA2的同时消耗n molAB
nmolA2的同时消耗n molAB
B.容器内,3种气体AB、A2、B2共存
C.AB的消耗速率等于A2的消耗速率
D.容器中各组分的体积分数不随时间变化
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com