
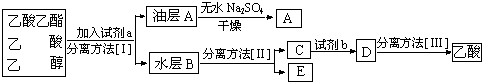
分析 (1)加入碎瓷片可防止液体暴沸;
(2)乙酸与乙醇在浓硫酸作用下加热发生酯化反应生成乙酸乙酯和水,该反应为可逆反应,增加乙醇的量平衡正向移动,提高乙酸的转化率;
(3)减小生产物的浓度的方法,平衡正向移动,可以提高酯的产率;
(4)分离粗产品乙酸乙酯、乙酸和乙醇的混合物,加入饱和碳酸钠溶液,乙酸乙酯不溶于饱和碳酸钠,采用分液的方法即可,水层中的乙酸钠要用硫酸反应得到乙酸,再蒸馏得到乙酸;
(5)①根据甲得到了显酸性的酯的混合物,说明加入的氢氧化钠溶液不足进行分析;
②根据乙酸乙酯能够与氢氧化钠溶液发生水解分析失败原因.
解答 解:(1)乙酸和乙醇的沸点较低,加热,加入碎瓷片可防止液体暴沸,故答案为:碎瓷片;防止烧瓶中液体暴沸;
(2)乙酸与乙醇在浓硫酸作用下加热发生酯化反应生成乙酸乙酯和水,该反应为可逆反应,增加乙醇的量平衡正向移动,提高乙酸的转化率,故答案为:提高乙酸的转化率;
(3)减小生产物的浓度的方法,平衡正向移动,可以提高酯的产率,故答案为:及时地蒸出生成物,有利于酯化反应向生成酯的方向进行;
(4)分离粗产品乙酸乙酯、乙酸和乙醇的混合物,加入饱和碳酸钠溶液,实现酯与乙酸和乙醇的分离,分离油层和水层采用分液的方法即可.对水层中的乙酸钠和乙醇进一步分离时应采取蒸馏操作分离出乙醇.然后水层中的乙酸钠要用硫酸反应得到乙酸,再蒸馏得到乙酸,
故答案为:a:饱和Na2CO3溶液;I:分液;II:蒸馏;b:硫酸;III:蒸馏;
(5)①甲得到显酸性的酯的混合物,酸有剩余,说明是所加NaOH溶液不足未将酸完全反应,故答案为:所加NaOH溶液不足未将酸完全反应;
②乙得到大量水溶性物质,说明没有酯,是因为所加NaOH溶液过量,酯发生水解,故答案为:所加NaOH溶液过量,酯发生水解.
点评 本题考查了常见物质的分离与提纯方法,题目难度中等,注意明确物质分离与提纯常用的方法,熟悉分液操作与蒸馏操作各适用于分离的混合物类型及正确操作方法.


 世纪百通主体课堂小学课时同步达标系列答案
世纪百通主体课堂小学课时同步达标系列答案 世纪百通优练测系列答案
世纪百通优练测系列答案科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ⑥⑦ | C. | ④⑥⑦ | D. | ⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 植物油是高分子化合物,不能使溴的四氯化碳溶液褪色 | |
| B. | 淀粉水解的最终产物是葡萄糖 | |
| C. | 葡萄糖能发生氧化反应和水解反应 | |
| D. | 蛋白质溶液遇硫酸铜后发生的沉淀能重新溶于水 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
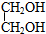 ,写出有关反应的化学方程式.CH3CH2Cl+NaOH$→_{△}^{乙醇}$CH2=CH2+NaCl+H2O;CH2=CH2+Cl2→CH2Cl-CH2Cl;CH2Cl-CH2Cl+2NaOH $→_{△}^{水}$HOCH2CH2OH+2NaCl.
,写出有关反应的化学方程式.CH3CH2Cl+NaOH$→_{△}^{乙醇}$CH2=CH2+NaCl+H2O;CH2=CH2+Cl2→CH2Cl-CH2Cl;CH2Cl-CH2Cl+2NaOH $→_{△}^{水}$HOCH2CH2OH+2NaCl.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 CH3COOCH2CH3+H2O,该反应类型为酯化反应(取代反应).
CH3COOCH2CH3+H2O,该反应类型为酯化反应(取代反应).查看答案和解析>>
科目:高中化学 来源:2016-2017学年江西省高二上月考一化学试卷(解析版) 题型:填空题
硫酸生产中,SO2催化氧化生成SO3:2SO2(g)+O2(g) 2SO3(g)△H<0
2SO3(g)△H<0
(1)如果2min内SO2的 浓度由6mol/L下降为2mol/L,那么,用O2浓度变化来表示的反应速率为 .
浓度由6mol/L下降为2mol/L,那么,用O2浓度变化来表示的反应速率为 .
(2)某温度下,SO2的平衡转化率(α)与体系总压强(p)的关系如图1所示.根据图示回答下列问题:
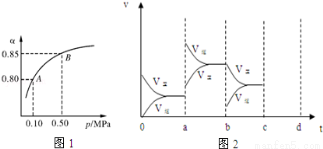
平衡状态由A变到B时平衡常数K(A) K(B)(填“>”、“<”或“=”).
(3)此反应在恒温密闭的装置中进行,能充分说明此反应已达到平衡的标志是 (填字母).
A.接触室中气体的平均相对分子质量不再改变
B.接触室中SO2、O2、SO3的浓度相同
C.接触室中SO2、SO3的物质的量之比为2:1:2
D.接触室中压强不随时间变化而变化
(4)图2表示该反应在密闭容器中达到平衡时,由于条件改变而引起反应速度和化学平衡的变化情况,a~ b过程中改变的条件可能是 ;b~c过程中改变的条件可能是 ; 若增大压强时,请把反应速率变化情况画在c~d处.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com