
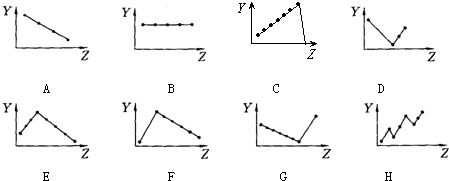
分析 (1)同一主族元素价电子数相等,与原子序数无关;
(2)ⅦA族元素氢化物的沸点随着原子序数增大而呈增大趋势,但HF沸点最高;
(3)第三周期元素单质的熔点随着原子序数增大先增大后减小;
(4)第三周期元素的最高正化合价随着原子序数增大而增大;
(5)IA族元素单质熔点随着原子序数增大而减小;
(6)电子层结构相同的离子其离子半径随着原子序数增大而减小.
解答 解:(1)同一主族元素价电子数相等,与原子序数无关,第IIA族元素价电子数都是2,故答案为:B;
(2)ⅦA族元素氢化物的晶体都是分子晶体,与其相对分子质量成正比,所以VIIA氢化物的沸点随着原子序数增大而呈增大趋势,但HF中含有氢键导致沸点最高,
故答案为:D;
(3)第三周期元素单质晶体类型依次为:金属晶体、原子晶体、分子晶体,所以其单质的熔点随着原子序数增大先增大后减小,原子晶体Si熔点最高,
故答案为:E;
(4)第三周期元素的最高正化合价随着原子序数增大而增大,故答案为:C;
(5)IA族元素单质中氢气是非金属单质,其余都是金属晶体,氢气单质的熔点最低,金属晶体的熔点与其原子半径成反比,所以碱金属族单质的熔点随着原子序数增大而减小,故答案为:F;
(6)电子层结构相同的离子其离子半径随着原子序数增大而减小,F-、Na+、Mg2+、Al3+四种离子的离子半径依次减小,故答案为:A.
点评 本题考查原子结构和元素性质,侧重考查元素周期律,熟练掌握同一周期、同一主族元素性质变化规律,并灵活运用这些规律解题,注意规律中的异常现象,注意(5)中第IA族元素要考虑H元素,为易错点.


 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 该物质属于两性氢氧化物 | |
| B. | 该药剂不适合于胃溃疡患者服用 | |
| C. | 1mol NaAl(OH)2CO3最多可消耗3molH+ | |
| D. | 该物质是Al(OH)3和Na2CO3的混合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 16O与18O互为同位素 | B. | 16O与18O具有不同的电子数 | ||
| C. | 16O与18O互为同素异形体 | D. | 16O与18O化学性质不同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径:Te>Cl>S | B. | 热稳定性:H2Te>H2S>PH3 | ||
| C. | 还原性:Cl->S2->Te2- | D. | 酸性:HClO4>H2SO4>H2TeO4 |
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江西省高二上月考一化学试卷(解析版) 题型:选择题
同温同压下,下列各组热化学方程式中,△H1<△H2是
A.C(s)+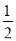 O2(g)=CO(g);△H1 C(s)+O2(g)=CO2(g);△H2
O2(g)=CO(g);△H1 C(s)+O2(g)=CO2(g);△H2
B.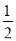 H2(g)+
H2(g)+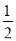 Cl2(g)=HCl(g);△H1 H2(g)+Cl2(g)=2HCl(g);△H2
Cl2(g)=HCl(g);△H1 H2(g)+Cl2(g)=2HCl(g);△H2
C.2H2(g)+O2(g)=2H2O(g);△H1 2H2(g)+O2(g)=2H2O(l);△H2
D.S(g)+O2(g)=SO2(g);△H1 S(s)+O2(g)=SO2(g);△H2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com