
| A. | 原子半径:Te>Cl>S | B. | 热稳定性:H2Te>H2S>PH3 | ||
| C. | 还原性:Cl->S2->Te2- | D. | 酸性:HClO4>H2SO4>H2TeO4 |
分析 元素周期表中,同一周期元素从左到右,原子半径逐渐减小、非金属性逐渐增强,同主族自上而下,原子半径增大、元素的非金属性减弱,元素的非金属性越强,对应的氢化物越稳定,阴离子的还原性越弱,最高价氧化物对应的水化物的酸性越强,
A.同周期元素,原子半径随着原子序数增大而减小,同主族自上而下原子半径增大;
B.非金属的非金属性越强,其氢化物越稳定;
C.非金属的非金属性越强,其阴离子的还原性越弱;
D.非金属的非金属性越强,其最高价含氧酸的酸性越强.
解答 解:A.同周期元素从左到右,原子半径逐渐减小,同主族元素从上到下,原子半径逐渐增大,则应有Te>S>Cl,故A错误;
B.非金属性S>P>Te,元素的非金属性越强,对应的氢化物越稳定,故B错误;
C.非金属性Cl>S>Te,元素的非金属性越强,对应的阴离子的还原性越弱,则还原性Te2->S2->Cl-,故C错误;
D.非金属性Cl>S>Te,元素的非金属性越强,对应的最高价氧化物的水化物的酸性越强,则酸性HClO4>H2SO4>H2TeO4,故D正确,
故选D.
点评 本题考查元素周期律知识,侧重于学生的分析应用能力的考查,注意把握同主族、同周期元素化合物的性质的相似性与递变性,难度不大.


 新思维假期作业暑假吉林大学出版社系列答案
新思维假期作业暑假吉林大学出版社系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
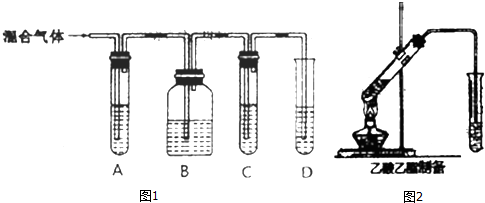
 CH3COOCH2CH3+H2O,该反应类型为酯化反应(取代反应).
CH3COOCH2CH3+H2O,该反应类型为酯化反应(取代反应).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 新制氯水显酸性,向其中滴加少量紫色石蕊试液,充分振荡后溶液呈红色 | |
| B. | 配制溶液时,若加水超过容量瓶刻度,应用胶头滴管将多余溶液吸出 | |
| C. | 煤油可由石油分馏获得,可用作燃料和保存少量金属钠 | |
| D. | 检验某溶液是否含有SO42-时,应取少量该溶液,依次加入BaCl2溶液和稀盐酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 现象相同,沉淀量相等 | B. | 现象相同,沉淀量不等 | ||
| C. | 现象不同,沉淀量相等 | D. | 现象不同,沉淀量不等 |
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江西省高二上10月月考化学试卷(解析版) 题型:选择题
把温度为20℃,浓度为1.0mol·L-1的H2SO4和2.2mol·L-1的碱溶液各50ml混合(溶液密度均为1g·ml-1,比热容为4.184kJ·K-1·kg-1),轻轻搅动。测得酸碱混合液的温度变化数据如下:
反应物 | 起始温度t1℃ | 终止温度t2℃ |
H2SO4+NaOH | 20 | 33.6 |
H2SO4+NH3·H2O | 20 | 32.6 |
则反应NH3·H2O=NH4++OH-的焓变约为( )(单位:kJ·mol-1)
A.2.1 B.4.2 C.52.7 D. 缺少数据无法计算
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江西省高二上月考一化学试卷(解析版) 题型:填空题
硫酸生产中,SO2催化氧化生成SO3:2SO2(g)+O2(g) 2SO3(g)△H<0
2SO3(g)△H<0
(1)如果2min内SO2的 浓度由6mol/L下降为2mol/L,那么,用O2浓度变化来表示的反应速率为 .
浓度由6mol/L下降为2mol/L,那么,用O2浓度变化来表示的反应速率为 .
(2)某温度下,SO2的平衡转化率(α)与体系总压强(p)的关系如图1所示.根据图示回答下列问题:
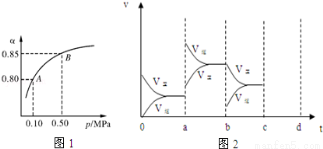
平衡状态由A变到B时平衡常数K(A) K(B)(填“>”、“<”或“=”).
(3)此反应在恒温密闭的装置中进行,能充分说明此反应已达到平衡的标志是 (填字母).
A.接触室中气体的平均相对分子质量不再改变
B.接触室中SO2、O2、SO3的浓度相同
C.接触室中SO2、SO3的物质的量之比为2:1:2
D.接触室中压强不随时间变化而变化
(4)图2表示该反应在密闭容器中达到平衡时,由于条件改变而引起反应速度和化学平衡的变化情况,a~ b过程中改变的条件可能是 ;b~c过程中改变的条件可能是 ; 若增大压强时,请把反应速率变化情况画在c~d处.
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
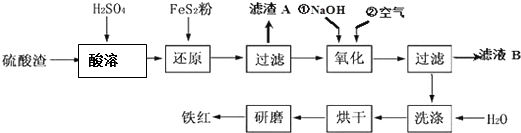
| 沉淀物 | Fe(OH)3 | Al(OH)3 | Fe(OH)2 | Mg(OH)2 |
| 开始沉淀pH | 2.7 | 3.8 | 7.6 | 9.4 |
| 完全沉淀pH | 3.2 | 5.2 | 9.7 | 12.4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com