
ЁОЬтФПЁПФмЙЛЫЎНтЕФФГгаЛњЛЏКЯЮяAОРюБШЯЃЗЈВтЕУЦфжаКЌЬМЮЊ72.0%ЁЂКЌЧтЮЊ6.67%ЃЌЦфгрШЋЮЊбѕЁЃЯжгУЯТСаЗНЗЈВтЖЈИУгаЛњЛЏКЯЮяЕФЯрЖдЗжзгжЪСПКЭЗжзгНсЙЙЁЃ
ЗНЗЈвЛЃКгУжЪЦзЗЈЗжЮіЕУжЊAЕФЯрЖдЗжзгжЪСПЮЊ150ЁЃ
ЗНЗЈЖўЃККЫДХЙВеёвЧВтГіAЕФКЫДХЙВеёЧтЦзга5ИіЗхЃЌЦфУцЛ§жЎБШЮЊ1ЁУ2ЁУ2ЁУ2ЁУ3ЃЌШчЭМ1ЁЃ
ЗНЗЈШ§ЃКРћгУКьЭтЙтЦзвЧВтЕУAЗжзгЕФКьЭтЙтЦзШчЭМ2ЁЃ


ЪдЬюПеЃК
ЃЈ1ЃЉAЕФЗжзгЪНЮЊ__ЁЃ
ЃЈ2ЃЉAЕФЗжзгжажЛКЌвЛИіМзЛљЕФвРОнЪЧ__(ЬюзжФИ)ЁЃ
a.AЕФЯрЖдЗжзгжЪСП
b.AЕФЗжзгЪН
c.AЕФКЫДХЙВеёЧтЦзЭМ
d.AЗжзгЕФКьЭтЙтЦзЭМ
ЃЈ3ЃЉAПЩФмЕФНсЙЙМђЪНЮЊ__ЁЃ
ЁОД№АИЁПC9H10O2 bc 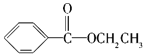 ЁЂ
ЁЂ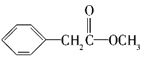 ЁЂ
ЁЂ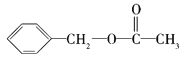
ЁОНтЮіЁП
(1)ИљОнгаЛњЮяжаИїдЊЫиЕФжЪСПЗжЪ§МАЯрЖдЗжзгжЪСПМЦЫуШЗЖЈЗжзгЪНЃЛ(2)МзЛљжаКЌга3ИіЧтдзгЃЌПЩвдИљОнгаЛњЮяжаЧтдзгЪ§ФПМАКЫДХЙВеёЧтЦзШЗЖЈМзЛљЕФЪ§ФПЃЛ(3)ИљОнгаЛњЮяЕФЗжзгЪННсКЯКьЭтЙтЦзжаДцдкЕФЛљЭХЗжЮіНсЙЙМђЪНЁЃ
(1) гаЛњЮяAжаCдзгИіЪ§NЃЈCЃЉ=![]() ЃЌгаЛњЮяAжаHдзгИіЪ§NЃЈHЃЉ=
ЃЌгаЛњЮяAжаHдзгИіЪ§NЃЈHЃЉ=![]() ЃЌгаЛњЮяAжаOдзгИіЪ§NЃЈOЃЉ=
ЃЌгаЛњЮяAжаOдзгИіЪ§NЃЈOЃЉ=![]() ЃЌЫљвдгаЛњЮяAЕФЗжзгЪНЮЊC9H10O2ЃЌЃЌЙЪД№АИЮЊЃКC9H10O2ЃЛ
ЃЌЫљвдгаЛњЮяAЕФЗжзгЪНЮЊC9H10O2ЃЌЃЌЙЪД№АИЮЊЃКC9H10O2ЃЛ
(2) AЕФКЫДХЙВеёЧтЦзга5ИіЗхЃЌЫЕУїЗжзгжага5жжHдзгЃЌЦфУцЛ§жЎБШЮЊЖдгІЕФИїжжHдзгИіЪ§жЎБШЃЌгЩЗжзгЪНПЩжЊЗжзгжаHдзгзмЪ§ЃЌНјЖјШЗЖЈМзЛљЪ§ФПЃЌЫљвдашвЊжЊЕРAЕФЗжзгЪНМАAЕФКЫДХЙВеёЧтЦзЭМЃЌЙЪД№АИЮЊЃКbcЃЛ
(3) гЩAЗжзгЕФКьЭтЙтЦзжЊЃЌКЌгаC6H5C-ЁЂЬМЬМЕЅМќЁЂC-HЁЂC=OЁЂC-O-CЕШЛљЭХЃЌдђНсЙЙжаКЌгаѕЅЛљЃЌИљОнКЫДХЙВеёЧтЦзга5жжЧтдзгЃЌЧвКЌгавЛИіМзЛљЗжЮіЃЌБНЛЗЩЯжЛгавЛИіШЁДњЛљЃЌЧвКЌгаѕЅЛљЃЌПЩФмНсЙЙга ЁЂ
ЁЂ ЁЂ
ЁЂ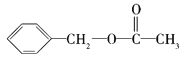 ЃЌЙЪД№АИЮЊЃК
ЃЌЙЪД№АИЮЊЃК ЁЂ
ЁЂ ЁЂ
ЁЂ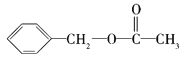 ЁЃ
ЁЃ


 ВНВНИпДяБъОэЯЕСаД№АИ
ВНВНИпДяБъОэЯЕСаД№АИ
| ФъМЖ | ИпжаПЮГЬ | ФъМЖ | ГѕжаПЮГЬ |
| ИпвЛ | ИпвЛУтЗбПЮГЬЭЦМіЃЁ | ГѕвЛ | ГѕвЛУтЗбПЮГЬЭЦМіЃЁ |
| ИпЖў | ИпЖўУтЗбПЮГЬЭЦМіЃЁ | ГѕЖў | ГѕЖўУтЗбПЮГЬЭЦМіЃЁ |
| ИпШ§ | ИпШ§УтЗбПЮГЬЭЦМіЃЁ | ГѕШ§ | ГѕШ§УтЗбПЮГЬЭЦМіЃЁ |
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПКЃЫЎжаКЌгаЗсИЛЕФУОзЪдДЁЃФГЭЌбЇЩшМЦСЫДгФЃФтКЃЫЎжажЦБИMgOЕФЪЕбщЗНАИЃК

ФЃФтКЃЫЎжаЕФРызгХЈЖШ/molЁЄLЃ1 | NaЃЋ | Mg2ЃЋ | Ca2ЃЋ | ClЃ | HCO3Ѓ |
0.439 | 0.050 | 0.011 | 0.560 | 0.001 |
зЂЃКШмвКжаФГжжРызгЕФХЈЖШаЁгк1.0ЁС10Ѓ5 molЁЄLЃ1ЃЌПЩШЯЮЊИУРызгВЛДцдкЃЛЪЕбщЙ§ГЬжаЃЌМйЩшШмвКЬхЛ§ВЛБфЁЃKsp[CaCO3]ЃН4.96ЁС10Ѓ9ЃЌKsp[MgCO3]ЃН6.82ЁС10Ѓ6ЃЌKsp[Ca(OH)2]ЃН4.68ЁС10Ѓ6ЃЌKsp[Mg(OH)2]ЃН5.61ЁС10Ѓ12ЁЃЯТСаЫЕЗЈе§ШЗЕФЪЧЃЈ ЃЉ
A.ГСЕэЮяXЮЊCaCO3
B.ТЫвКMжаДцдкMg2ЃЋЃЌВЛДцдкCa2ЃЋ
C.ТЫвКNжаДцдкMg2ЃЋЁЂCa2ЃЋ
D.ВНжшЂкжаШєИФЮЊМгШы4.2 g NaOHЙЬЬхЃЌГСЕэЮяYЮЊCa(OH)2КЭMg(OH)2ЕФЛьКЯЮя
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПДгКъЙлКЭЮЂЙлСНИіНЧЖШШЯЪЖТШЁЂСђЁЂЬњЁЂТСЕШдЊЫиЕФЕЅжЪМАЦфЛЏКЯЮяЪЧбЇКУжабЇЛЏбЇЕФживЊЛљДЁЁЃЭъГЩЯТСаЬюПеЃК
ЃЈ1ЃЉClдкдЊЫижмЦкБэжаЕФЮЛжУЮЊ______________ЃЌгЩДЫПЩжЊЃЌЦфзюИпМлбѕЛЏЮяЖдгІЕФЫЎЛЏЮяЕФЛЏбЇЪН ЮЊЃК______________ ЃЌДЮТШЫсЗжзгЕФНсЙЙЪНЮЊЃК_____________ЁЃ
ЃЈ2ЃЉClЁЂSЁЂNaШ§жждЊЫиаЮГЩМђЕЅРызгЦфАыОЖгЩДѓЕНаЁЕФЫГађЪЧ_______________________ЃЈгУРызгЗћКХ БэЪОЃЉЁЃТСзюИпМлбѕЛЏЮяЖдгІЕФЫЎЛЏЮяБэЯжГіСЫЖРЬиЕФаджЪЃЌЦфдкЫЎШмвКжаЕФЕчРыЗНГЬЪН ЮЊ____________________________________________________________________________ЁЃ
ЃЈ3ЃЉСђКЭТШЕФЗЧН№ЪєадЧПШѕЙиЯЕЪЧ_________________ЃЌЪдДгдзгНсЙЙЕФНЧЖШНтЪЭЦфдвђЁЃ______________
ЃЈ4ЃЉЯжгаЪдМСЃКфхЫЎЁЂСђЛЏФЦШмвКЁЂNa2SO3ШмвКЁЂЯЁСђЫсЁЂNaOHШмвКЁЂАБЫЎЁЃвЊжЄУїNa2SO3ОпгаЛЙд адЃЌгІбЁгУЕФЪдМСга______________ЃЌПДЕНЕФЯжЯѓЪЧ ____________________ЁЃвЊжЄУїNa2SO3ОпгабѕЛЏадЃЌгІбЁгУЕФЪдМСга___________________ЃЌЗДгІЕФРызгЗНГЬЪНЪЧ ________________________________ЁЃ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁП
Ђё.ЖдгкПЩФцЗДгІCO+H2O(g)![]() CO2+H2ЃЌЛиД№ЯТСаЮЪЬтЃК
CO2+H2ЃЌЛиД№ЯТСаЮЪЬтЃК
(1)830 KЪБЃЌШєЦ№ЪМЪБc(CO)=2 molЁЄL-1ЃЌc(H2O)=3 molЁЄL-1ЃЌЦНКтЪБCOЕФзЊЛЏТЪЮЊ60%ЃЌЫЎеєЦјЕФзЊЛЏТЪЮЊ _____________;ЦНКтГЃЪ§KЕФжЕЮЊ _____________ЁЃ
(2)830 KЪБЃЌШєжЛНЋЦ№ЪМЪБc(H2O)ИФЮЊ6 molЁЄL-1ЃЌдђЫЎеєЦјЕФзЊЛЏТЪЮЊ_____________ ЁЃ
(3)Шє830 KЪБЃЌФГЪБПЬЛьКЯЬхЯЕжаИїЦјЬхЕФХЈЖШЮЊc(CO2)=0.4 molЁЄL-1c(CO)=0.6 molЁЄL-1c(H2O)=3 molЁЄL-1ЃЌc(H2)=2 molЁЄL-1ЧыХаЖЈИУЬхЯЕжаЗДгІНјааЕФЗНЯђЃК______________ (ЬюЁАе§ЯђНјааЁБЁАФцЯђНјааЁБЛђЁАДяЕНЦНКтЁБ)ЁЃ
ЂђКуЮТКубЙЯТЃЌдквЛИіШнЛ§ПЩБфЕФШнЦїжаЗЂЩњШчЯТЗДгІЃКA(g)+B(g) ![]() C(g)
C(g)
(1)ШєПЊЪМЪБЗХШы1mol AКЭ1mol BЃЌДяЕНЦНКтКѓЃЌЩњГЩa mol CЃЌетЪБAЕФЮяжЪЕФСПЮЊ _______ molЁЃ
(2)ШєПЊЪМЪБЗХШы3mol AКЭ3mol BЃЌДяЕНЦНКтКѓЃЌЩњГЩCЕФЮяжЪЕФСПЮЊ _______molЁЃ
(3)ШєПЊЪМЪБЗХШыx mol A2mol BКЭ1mol CЃЌДяЕНЦНКтКѓЃЌAКЭCЕФЮяжЪЕФСПЗжБ№ЮЊy molКЭ3a molЃЌдђx= ______ЃЌy= _________ЁЃ
(4)Шєдк(3)ЕФЦНКтЛьКЯЮяжадйМгШы3mol CЃЌД§дйДЮДяЕНЦНКтКѓЃЌCЕФЮяжЪЕФСПЗжЪ§ЪЧ _______ЁЃ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПАБбѕЛЏЗЈЪЧЙЄвЕЩњВњжажЦШЁЯѕЫсЕФжївЊЭООЖЃЌФГЭЌбЇгУИУдРэдкЪЕбщЪвЬНОПЯѕЫсЕФжЦБИКЭаджЪЃЌЩшМЦСЫШчЯТЭМЫљЪОЕФзАжУЃК
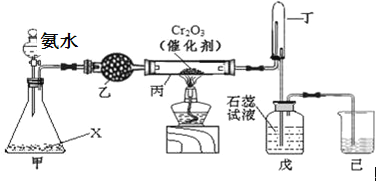
ЃЈ1ЃЉШєЗжвКТЉЖЗжаАБЫЎЕФХЈЖШЮЊ9.0molLЉ1ЃЌХфжЦИУХЈЖШЕФАБЫЎ100mLЃЌгУЕНЕФВЃСЇвЧЦїга100mLШнСПЦПЁЂЩеБЁЂВЃСЇАєЁЂ ЁЃ
ЃЈ2ЃЉМззАжУВЛашвЊМгШШМДФмЭЌЪБВњЩњАБЦјКЭбѕЦјЃЌЩеЦПФкЙЬЬхXЕФУћГЦЮЊ ЁЃ
ЃЈ3ЃЉввзАжУЕФзїгУЪЧ ЃЛаДГіЪмШШЪББћзАжУЗЂЩњЗДгІЕФЛЏбЇЗНГЬЪНЮЊ ЁЃ
ЃЈ4ЃЉЕБЮьжаЙлВьЕН ЯжЯѓЃЌдђЫЕУївбжЦЕУЯѕЫсЁЃФГЭЌбЇАДЩЯЭМзщзАвЧЦїВЂМьбщЦјУмадКѓНјааЪЕбщЃЌУЛгаЙлВьЕНДЫЯжЯѓЃЌЧыЗжЮіЪЕбщЪЇАмЕФПЩФмдвђ ЁЃШчКЮИФНјжУ ЁЃ
ЃЈ5ЃЉИФНјКѓД§ЗДгІНсЪјЃЌНЋЖЁзАжУЕЙСЂдкЪЂЫЎЕФЫЎВлжаЃЌЛсЙлВьЕНЕФЯжЯѓЪЧ ЁЃ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПдквЛЖЈЮТЖШЯТЃЌЯђ2 LКуШнУмБеШнЦїжаГфШы1mol AЃЌЗЂЩњA(g) ![]() B(g) + C(g)ЗДгІЁЃЗДгІЙ§ГЬжаc(C)ЫцЪБМфБфЛЏЕФЧњЯпШчЯТЭМЫљЪОЃЌЯТСаЫЕЗЈВЛе§ШЗЕФЪЧЃЈ ЃЉ
B(g) + C(g)ЗДгІЁЃЗДгІЙ§ГЬжаc(C)ЫцЪБМфБфЛЏЕФЧњЯпШчЯТЭМЫљЪОЃЌЯТСаЫЕЗЈВЛе§ШЗЕФЪЧЃЈ ЃЉ
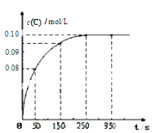
AЃЎЗДгІдк 0 ~50 s ЕФЦНОљЫйТЪv(C)=1.6ЁС10-3mo1/(L s)
BЃЎИУЮТЖШЯТЃЌЗДгІЕФЦНКтГЃЪ§жЕЮЊ0.025
CЃЎЗДгІЦНКтКѓЃЌдйЯђШнЦїжаГфШыAЁЂBЁЂCИї1molЃЌДЫЪБv(е§)<v(Фц)
DЃЎБЃГжЦфЫћЬѕМўВЛБфЃЌЩ§ИпЮТЖШЃЌЦНКтЪБc(B)=0.11mol/LЃЌдђИУЗДгІЕФЁїH<0
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПГЃЮТЯТ0.1molLЉ1ДзЫсШмвКЕФpH=aЃЌЯТСаФмЪЙШмвКpH=ЃЈa+1ЃЉЕФДыЪЉЪЧ
A. НЋШмвКЯЁЪЭЕНдЬхЛ§ЕФ2БЖB. МгШыЪЪСПЕФДзЫсФЦЙЬЬх
C. МгШыЕШЬхЛ§0.2 molLЉ1бЮЫсD. МгЩйСПБљДзЫс
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПФГЪЕбщаЁзщбаОПЮТЖШЖдЛЏбЇЗДгІ![]() ЕФгАЯьЃЌдкЦфЫћЬѕМўЯрЭЌЪБЃЌНЋ
ЕФгАЯьЃЌдкЦфЫћЬѕМўЯрЭЌЪБЃЌНЋ![]() КЭ
КЭ![]() ГфШыЬхЛ§ЮЊ2LЕФКуШнУмБеШнЦїжаЃЌВтЕУ
ГфШыЬхЛ§ЮЊ2LЕФКуШнУмБеШнЦїжаЃЌВтЕУ![]() ЕФЮяжЪЕФСПЗжЪ§ЫцЪБМф
ЕФЮяжЪЕФСПЗжЪ§ЫцЪБМф![]() БфЛЏЕФЪЕбщЪ§ОнШчЯТЃК
БфЛЏЕФЪЕбщЪ§ОнШчЯТЃК
ЪБМф | 0 | 20 | 40 | 60 | 80 | 100 | |
|
| 0 |
|
|
|
|
|
| 0 |
|
|
|
|
| |
ЯТСаЫЕЗЈе§ШЗЕФЪЧ ![]()
![]()
A. ![]() ЮТЖШЯТЃЌ
ЮТЖШЯТЃЌ![]() жЎМфЃЌ
жЎМфЃЌ![]() ЕФЦНОљЗДгІЫйТЪЮЊ
ЕФЦНОљЗДгІЫйТЪЮЊ![]()
B. дк![]() ЮТЖШЯТЃЌИУЗДгІгаПЩФмдк70minЪБвбДяЕНЦНКтзДЬЌ
ЮТЖШЯТЃЌИУЗДгІгаПЩФмдк70minЪБвбДяЕНЦНКтзДЬЌ
C. гЩБэжаЪ§ОнЭЦВтЃЌ![]()
D. гЩБэжаЪ§ОнПЩжЊЃЌЮТЖШдНИпЃЌ![]() гы
гы![]() ЕФЗДгІЯоЖШдНДѓ
ЕФЗДгІЯоЖШдНДѓ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПГєбѕдкбЬЦјЭбЯѕжаЕФЗДгІЮЊ2NO2(g)ЃЋO3(g)![]() N2O5(g)ЃЋO2(g)ЁЃШєДЫЗДгІдкКуШнУмБеШнЦїжаНјааЃЌЯрЙиЭМЯёШчЯТЃЌЦфжаЖдгІЗжЮіНсТле§ШЗЕФЪЧ(ЁЁЁЁ)
N2O5(g)ЃЋO2(g)ЁЃШєДЫЗДгІдкКуШнУмБеШнЦїжаНјааЃЌЯрЙиЭМЯёШчЯТЃЌЦфжаЖдгІЗжЮіНсТле§ШЗЕФЪЧ(ЁЁЁЁ)
A.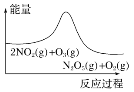 ЦНКтКѓНЕЮТЃЌNO2КЌСПНЕЕЭ
ЦНКтКѓНЕЮТЃЌNO2КЌСПНЕЕЭ
B.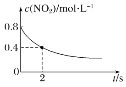 0ЁЋ2 sФкЃЌІд(O3)ЃН0.2 molЁЄLЃ1ЁЄsЃ1
0ЁЋ2 sФкЃЌІд(O3)ЃН0.2 molЁЄLЃ1ЁЄsЃ1
C.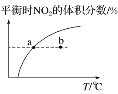 Іде§ЃКbЕу<aЕуЃЌbЕуЃКІдФц<Іде§
Іде§ЃКbЕу<aЕуЃЌbЕуЃКІдФц<Іде§
D.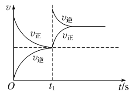 КуЮТЃЌt1ЪБдйГфШыO3
КуЮТЃЌt1ЪБдйГфШыO3
ВщПДД№АИКЭНтЮі>>
ЙњМЪбЇаЃгХбЁ - СЗЯАВсСаБэ - ЪдЬтСаБэ
КўББЪЁЛЅСЊЭјЮЅЗЈКЭВЛСМаХЯЂОйБЈЦНЬЈ | ЭјЩЯгаКІаХЯЂОйБЈзЈЧј | ЕчаХеЉЦОйБЈзЈЧј | ЩцРњЪЗащЮожївхгаКІаХЯЂОйБЈзЈЧј | ЩцЦѓЧжШЈОйБЈзЈЧј
ЮЅЗЈКЭВЛСМаХЯЂОйБЈЕчЛАЃК027-86699610 ОйБЈгЪЯфЃК58377363@163.com