
【题目】海水中含有丰富的镁资源。某同学设计了从模拟海水中制备MgO的实验方案:

模拟海水中的离子浓度/mol·L-1 | Na+ | Mg2+ | Ca2+ | Cl- | HCO3- |
0.439 | 0.050 | 0.011 | 0.560 | 0.001 |
注:溶液中某种离子的浓度小于1.0×10-5 mol·L-1,可认为该离子不存在;实验过程中,假设溶液体积不变。Ksp[CaCO3]=4.96×10-9,Ksp[MgCO3]=6.82×10-6,Ksp[Ca(OH)2]=4.68×10-6,Ksp[Mg(OH)2]=5.61×10-12。下列说法正确的是( )
A.沉淀物X为CaCO3
B.滤液M中存在Mg2+,不存在Ca2+
C.滤液N中存在Mg2+、Ca2+
D.步骤②中若改为加入4.2 g NaOH固体,沉淀物Y为Ca(OH)2和Mg(OH)2的混合物
【答案】A
【解析】
步骤①,加入0.001molNaOH时,OH-恰好与HCO3-完全反应,生成0.001molCO32-。由于Ksp(CaCO3)<Ksp(MgCO3),生成的CO32-与水中的Ca2+反应生成CaCO3沉淀,滤液M中同时存在着Ca2+和Mg2+;
步骤②,当滤液M中加入NaOH固体,调至pH=11(即pOH=3)时,此时滤液中c(OH-)=1×10-3molL-1.
根据溶度积可判断无Ca(OH)2生成,有Mg(OH)2沉淀生成,据此分析判断。
A.步骤①,从题给的条件,可知n(NaOH)=0.001mol,[即n(OH-)=0.001mol]。依据离子反应“先中和、后沉淀、再其他”的反应规律,当1L模拟海水中,加入0.001molNaOH时,OH-恰好与HCO3-完全反应:OH-+HCO3-=CO32-+H2O,生成0.001molCO32-。由于Ksp(CaCO3)<Ksp(MgCO3),此时c(Ca2+)c(CO32-)>Ksp(CaCO3),生成的CO32-与水中的Ca2+反应生成CaCO3沉淀Ca2++CO32-=CaCO3↓,沉淀溶液中剩余c(Ca2+)约为0.010molL-1,c(CO32-)约为4.96×10-7 molL-1,没有MgCO3生成,所以沉淀物X为CaCO3,故A正确;
B.由于CO32-只有0.001mol,反应生成CaCO3所消耗的Ca2+也只有0.001mol,滤液中还剩余c(Ca2+)=0.010molL-1.滤液M中同时存在着Ca2+和Mg2+,故B错误;
C.步骤②,当滤液M中加入NaOH固体,调至pH=11(即pOH=3)时,此时滤液中c(OH-)=1×10-3molL-1,则Qc[Ca(OH)2]=c(Ca2+)×(10-3)2=0.010×(10-3)2=10-8<Ksp[Ca(OH)2],无Ca(OH)2生成。Qc[Mg(OH)2]=c(Mg2+)×(10-3)2=0.050×(10-3)2=5×10-8>Ksp[Mg(OH)2],有Mg(OH)2沉淀生成。又由于Ksp[Mg(OH)2]=c(Mg2+)×(10-3)2=5.61×10-12,c(Mg2+)=5.61×10-6<10-5,无剩余,滤液N中不存在Mg2+,故C错误;
D.步骤②中若改为加入4.2gNaOH固体,则n(NaOH)=0.105mol,与0.05molMg2+反应:Mg2++2OH-=Mg(OH)2↓,生成0.05molMg(OH)2,剩余0.005molOH-。由于Qc[Ca(OH)2]=c(Ca2+)×c(OH-)2=0.010×(0.005)2=2.5×10-7<Ksp[Ca(OH)2],所以无Ca(OH)2沉淀析出,沉淀物Y为Mg(OH)2沉淀,故D错误;
故选A。


科目:高中化学 来源: 题型:
【题目】常温下,向Na2CO3溶液中逐滴滴入0.1mol·L-1盐酸,溶液的pH随着滴入盐酸溶液体积变化曲线如下图,则下列说法正确的是( )
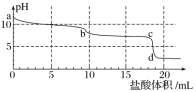
A.a点时溶液pH=11.5,原因是:CO32—+2H2O===H2CO3+2OH-
B.a~b段发生反应为:CO32—+2H+===CO2↑+H2O
C.b~c段发生反应为:HCO3—+H+===CO2↑+H2O
D.c~d段发生反应为:H++OH-===H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,使一定量的A和B气体混合发生反应:![]() 。下列描述中,说明反应已经达到平衡状态的是( )
。下列描述中,说明反应已经达到平衡状态的是( )
A.各物质的浓度之比![]()
B.混合气体中各物质的浓度相等
C.单位时间内,若消耗了![]() A,同时也消耗了
A,同时也消耗了![]() C
C
D.混合气体的体积是反应开始前的![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
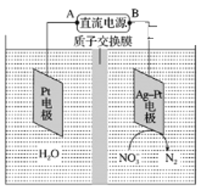
【题目】(1)催化硝化法和电化学降解法可用于治理水中硝酸盐的污染。
①催化硝化法中,用H2将NO3—还原为N2,一段时间后,溶液的碱性明显增强。则该反应离子方程式为____。
②电化学降解NO3—的原理如图所示,电源正极为________(填“A”或 B”),若总反应4NO3-+4H+=5O2+2N2+2H2O,则阴极反应式为_______。
③能否把质子交换膜改为阴离子交换膜____________(填“能“或”不能”)。
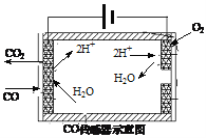
(2)研究和深度开发CO、CO2的应用对构建生态文明社会具有重要的意义。
①CO与O2设计成燃料电池(以KOH溶液为电解液)。该电池的负极反应式为______。
②测量汽车尾气中的CO浓度常用电化学气敏传感器,可用图简单表示,则阳极发生的电极反应为_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列操作或试剂的选择合理的是( )
A.焰色反应时需用稀硫酸洗净铂丝,并在火焰上灼烧至无色。
B.用湿润的pH试纸测得某碱性溶液的pH为13
C.提纯混有少量硝酸钾的氯化钠,应采用在较高温度下制得浓溶液再冷却结晶、过滤、干燥的方法
D.用丁达尔效应可鉴别![]() 溶液和
溶液和![]() 胶体
胶体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知H2S与CO2在高温下发生反应:H2S(g)+CO2(g)COS(g)+H2O(g)△H=﹣Q kJmol﹣1 (Q>0)。在温度为T1时,将0.10molCO2与0.40mol H2S充入2.5L 的空钢瓶中,经过4min反应达到平衡,平衡时H2O(g)的物质的量分数为 2%,则下列说法不正确的是( )
A.0~4 min内用H2S表示该反应的速率为0.001 molL﹣1min﹣1
B.CO2的平衡转化率α=2.5%
C.上述条件下反应达到平衡时放出的热量为0.01Q kJ
D.其他条件不变,若该反应在温度为T2 条件下进行,达到平衡所需时间小于4 min,则 T1<T2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列可以证明2HI(g)![]() H2(g)+I2(g)已达平衡状态的是( )
H2(g)+I2(g)已达平衡状态的是( )
①单位时间内生成nmolH2的同时生成nmolHI
②一个H—H键断裂的同时有两个H—I键断裂
③温度和体积一定时,混合气体密度不再变化
④v(H2)=v(I2)=0.5v(HI)
⑤c(HI):c(H2):c(I2)=2:1:1
⑥温度和体积一定时,某一生成物浓度不再变化
⑦温度和体积一定时,容器内压强不再变化
⑧温度和压强一定时,混合气体的平均相对分子质量不再变化
⑨温度和体积一定时,混合气体的颜色不再变化
A. ②③④⑤⑥B. ②⑥⑦⑧⑨
C. ①②⑥⑧D. ②⑥⑨
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表所列各组物质中,不能通过一步反应实现如图所示转化的是( )
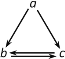
物质 选项 | a | b | c |
A. | AlCl3 | Al(OH)3 | NaAlO2 |
B. | HNO3 | NO | NO2 |
C. | Si | SiO2 | Na2SiO3 |
D. | Fe | FeCl2 | FeCl3 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能够水解的某有机化合物A经李比希法测得其中含碳为72.0%、含氢为6.67%,其余全为氧。现用下列方法测定该有机化合物的相对分子质量和分子结构。
方法一:用质谱法分析得知A的相对分子质量为150。
方法二:核磁共振仪测出A的核磁共振氢谱有5个峰,其面积之比为1∶2∶2∶2∶3,如图1。
方法三:利用红外光谱仪测得A分子的红外光谱如图2。


试填空:
(1)A的分子式为__。
(2)A的分子中只含一个甲基的依据是__(填字母)。
a.A的相对分子质量
b.A的分子式
c.A的核磁共振氢谱图
d.A分子的红外光谱图
(3)A可能的结构简式为__。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com