
【题目】下表所列各组物质中,不能通过一步反应实现如图所示转化的是( )
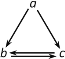
物质 选项 | a | b | c |
A. | AlCl3 | Al(OH)3 | NaAlO2 |
B. | HNO3 | NO | NO2 |
C. | Si | SiO2 | Na2SiO3 |
D. | Fe | FeCl2 | FeCl3 |
A.AB.BC.CD.D
【答案】C
【解析】
A、AlCl3与氨水反应可生成Al(OH)3,Al(OH)3与NaOH溶液反应可生成NaAlO2,NaAlO2溶液与CO2反应生成Al(OH)3,AlCl3与过量的NaOH反应生成NaAlO2,均可通过一步反应实现;
B、稀硝酸与Cu反应可生成NO,NO与O2反应生成NO2,浓硝酸与Cu反应生成NO2,NO2与H2O反应生成NO,均可通过一步反应实现;
C、Na2SiO3不能通过一步反应转化为SiO2;
D、Fe与盐酸反应生成FeCl2,Fe在Cl2中燃烧生成FeCl3,FeCl2与Cl2反应生成FeCl3,FeCl3与Fe反应可生成FeCl2,均可通过一步反应实现;
答案选C。


科目:高中化学 来源: 题型:
【题目】下列实验操作不能达到实验目的的是( )
A. 用加热的方法除去碳酸钠固体中的碳酸氢钠
B. 加热蒸干溶液,可以得到CuCl2晶体
C. 放在流动的蒸馏水中可除去半透膜中蛋白质溶液里混有的(NH4)2SO4
D. 鉴别NaBr和KI溶液,可分别加新制氯水后,用CCl4萃取
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水中含有丰富的镁资源。某同学设计了从模拟海水中制备MgO的实验方案:

模拟海水中的离子浓度/mol·L-1 | Na+ | Mg2+ | Ca2+ | Cl- | HCO3- |
0.439 | 0.050 | 0.011 | 0.560 | 0.001 |
注:溶液中某种离子的浓度小于1.0×10-5 mol·L-1,可认为该离子不存在;实验过程中,假设溶液体积不变。Ksp[CaCO3]=4.96×10-9,Ksp[MgCO3]=6.82×10-6,Ksp[Ca(OH)2]=4.68×10-6,Ksp[Mg(OH)2]=5.61×10-12。下列说法正确的是( )
A.沉淀物X为CaCO3
B.滤液M中存在Mg2+,不存在Ca2+
C.滤液N中存在Mg2+、Ca2+
D.步骤②中若改为加入4.2 g NaOH固体,沉淀物Y为Ca(OH)2和Mg(OH)2的混合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,改变反应物中n(SO2),对反应2SO2(g)+O2(g)2SO3(g) ΔH<0的影响如图所示,下列说法正确的是( )
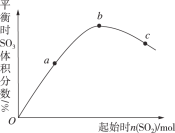
A.反应bc点均为平衡点,a点未达到平衡且向正反应方向进行
B.abc三点的平衡常数Kb>Kc>Ka
C.上述图象可以得出SO2的含量越高得到的混合气体中SO3的体积分数越高
D.abc三点中,a点时SO2的转化率最高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:酸式乙二酸钠与浓硫酸共热时反应为![]() 。利用该反应所产生的气体(X)用有关仪器装置进行实验:
。利用该反应所产生的气体(X)用有关仪器装置进行实验:
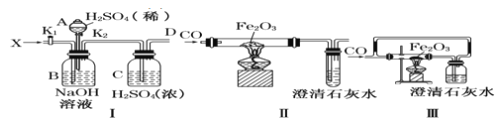
下列说法不正确的是( )
A.对I装置,活塞![]() 关闭,打开活塞
关闭,打开活塞![]() ,在导管D处能得到纯净而干燥的CO
,在导管D处能得到纯净而干燥的CO
B.当A选项反应完成后,再关闭活塞![]() ,打开活塞
,打开活塞![]() ,在导管D处得到纯净而干燥的
,在导管D处得到纯净而干燥的![]()
C.利用装置I中D处所得纯净CO气体,通过实验装置II能够说明CO具有还原性
D.实验装置III与实验装置II相比较,能减少CO污染,能顺利完成氧化铁还原实验
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上以粗铜为原料采取如图所示流程制备硝酸铜晶体。
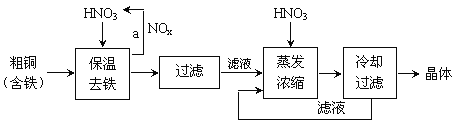
下列说法错误的是
A.步骤a中还需要加入适量的氧气和水
B.保温去铁后过滤,铁元素主要以+2价的沉淀形式被过滤出去
C.蒸发浓缩的过程中加入适当的硝酸,目的是抑制硝酸铜的水解
D.硝酸铜溶液中离子浓度大小:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从宏观和微观两个角度认识氯、硫、铁、铝等元素的单质及其化合物是学好中学化学的重要基础。完成下列填空:
(1)Cl在元素周期表中的位置为______________,由此可知,其最高价氧化物对应的水化物的化学式 为:______________ ,次氯酸分子的结构式为:_____________。
(2)Cl、S、Na三种元素形成简单离子其半径由大到小的顺序是_______________________(用离子符号 表示)。铝最高价氧化物对应的水化物表现出了独特的性质,其在水溶液中的电离方程式 为____________________________________________________________________________。
(3)硫和氯的非金属性强弱关系是_________________,试从原子结构的角度解释其原因。______________
(4)现有试剂:溴水、硫化钠溶液、Na2SO3溶液、稀硫酸、NaOH溶液、氨水。要证明Na2SO3具有还原 性,应选用的试剂有______________,看到的现象是 ____________________。要证明Na2SO3具有氧化性,应选用的试剂有___________________,反应的离子方程式是 ________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
Ⅰ.对于可逆反应CO+H2O(g)![]() CO2+H2,回答下列问题:
CO2+H2,回答下列问题:
(1)830 K时,若起始时c(CO)=2 mol·L-1,c(H2O)=3 mol·L-1,平衡时CO的转化率为60%,水蒸气的转化率为 _____________;平衡常数K的值为 _____________。
(2)830 K时,若只将起始时c(H2O)改为6 mol·L-1,则水蒸气的转化率为_____________ 。
(3)若830 K时,某时刻混合体系中各气体的浓度为c(CO2)=0.4 mol·L-1c(CO)=0.6 mol·L-1c(H2O)=3 mol·L-1,c(H2)=2 mol·L-1请判定该体系中反应进行的方向:______________ (填“正向进行”“逆向进行”或“达到平衡”)。
Ⅱ恒温恒压下,在一个容积可变的容器中发生如下反应:A(g)+B(g) ![]() C(g)
C(g)
(1)若开始时放入1mol A和1mol B,达到平衡后,生成a mol C,这时A的物质的量为 _______ mol。
(2)若开始时放入3mol A和3mol B,达到平衡后,生成C的物质的量为 _______mol。
(3)若开始时放入x mol A2mol B和1mol C,达到平衡后,A和C的物质的量分别为y mol和3a mol,则x= ______,y= _________。
(4)若在(3)的平衡混合物中再加入3mol C,待再次达到平衡后,C的物质的量分数是 _______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组研究温度对化学反应![]() 的影响,在其他条件相同时,将
的影响,在其他条件相同时,将![]() 和
和![]() 充入体积为2L的恒容密闭容器中,测得
充入体积为2L的恒容密闭容器中,测得![]() 的物质的量分数随时间
的物质的量分数随时间![]() 变化的实验数据如下:
变化的实验数据如下:
时间 | 0 | 20 | 40 | 60 | 80 | 100 | |
|
| 0 |
|
|
|
|
|
| 0 |
|
|
|
|
| |
下列说法正确的是 ![]()
![]()
A. ![]() 温度下,
温度下,![]() 之间,
之间,![]() 的平均反应速率为
的平均反应速率为![]()
B. 在![]() 温度下,该反应有可能在70min时已达到平衡状态
温度下,该反应有可能在70min时已达到平衡状态
C. 由表中数据推测,![]()
D. 由表中数据可知,温度越高,![]() 与
与![]() 的反应限度越大
的反应限度越大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com