
【题目】硫代硫酸钠可作为脱氯剂,已知25.0 mL 0.100 mol·L-1Na2S2O3溶液恰好把224 mL(标准状况下) Cl2完全转化为Cl-,则S2O32—将转化为
A.S2-B.SO32-C.SD.SO42-
科目:高中化学 来源: 题型:
【题目】①如图Ⅰ表示10mL量筒中液面的位置.A与B,B与C刻度间相差1mL,如果刻度A为6,量筒中液体的体积是mL.
②图Ⅱ表示50mL滴定管中液面的位置.如果液面处的 读数是a,则滴定管中液体的体积(填代号) .
A.是a mL B.一定大于a mL
C.是(50﹣a) mL D.一定大于(50﹣a) mL.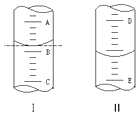
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,测得0.1mol·L-1某溶液的pH值大于7,则该溶液中可能的溶质为
A. KCl B. NH3 C. NaNO3 D. CH3COOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应A(g)+B(g)C(g)+D(g)过程中的能量变化如图所示,
①正反应为放热反应
②反应物总能量低于生成物总能量
③反应物的总键能小于生成物的总键能
④1molA与1molB充分反应后,能量变化为△E
⑤加入催化剂后,反应加快,△E减小
⑥反应达到平衡时,升高温度,A的转化率增大
⑦升高温度可增大正反应速率,降低逆反应速率
⑧E2是反应C(g)+D(g)A(g)+B(g) 的活化能
以上有关说法正确的是( )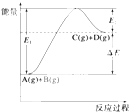
A.⑤⑥⑦⑧
B.①②③④
C.①③⑤⑦
D.②⑥⑧
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮及其化合物与生产生活关系密切。请完成下列填空:
(1)某学校化学学习小组为探究二氧化氮的性质,按下图所示装置进行实验。

①装置甲中盛放浓硝酸的仪器A的名称是______, 装置丙中的试管内发生反应的离子方程式为:_______________________。
②为了探究NO的还原性,可以在装置丁的导气管C中通入一种气体,通入的这种气体的名称是____________。
(2)NO在医疗上有重要的应用,曾被科学家作为研究的重要物质。现有容积为aL的试管盛满NO后倒扣于水槽中,再向试管中通入一定体积O2后,试管内气体的体积为试管容积的一半,则通入的O2的在相同条件下体积为_________。
A 0.75aL B 0.375aL C 0.625aL D 1.25aL
(3)实验室常用下图所示装置制取并收集氨气。

①实验室制取氨气反应的化学方程式为____________________________________;
②图中方框内收集氨气的装置可选用_________________(填字母序号);
③尾气处理装置中使用倒扣漏斗的作用是_________________________________。
(4)在盛有一定量浓硝酸的试管中加入6.4g的铜片发生反应。请回答下列问题:
①开始阶段,反应的化学方程式为____________________________________,后一阶段生成气体的颜色为____________,若整个反应过程共产生标准状况下气体2.24L,则反应过程中被还原的HNO3的物质的量为_______。
②反应结束后铜片有剩余,再加入少量20%的稀硫酸,这时铜片上又有气泡产生,反应的离子方程式为____________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B是两种常见的无机物,它们分别能与下图中周围4种物质在一定条件下反应:请回答下列问题:
(1)A溶液与B溶液反应的离子方程式 .
(2)若A与其周围某物质在一定条件下反应,产物之一是B周围的一种,则此反应的离子方程式为
(3)请写出B溶液分别与Cl2、Al(OH)3反应的离子方程式:
(4)在A、B周围的8种物质中,有些既能与A反应又能与B反应.则这些物质可能是: . 
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯气是一种重要的工业原料.
(1)Ⅰ.实验室可用二氧化锰和浓盐酸反应制取氯气,反应的化学方程式是 .
(2)Ⅱ.某研究性学习小组查阅资料得知,漂白粉与硫酸反应可制取氯气,化学方程式为:Ca(ClO)2+CaCl2+2H2SO4 ![]() 2CaSO4+2Cl2↑+2H2O
2CaSO4+2Cl2↑+2H2O
他们利用该反应设计如下制取氯气并验证其性质的实验.
回答下列问题:
①该实验中A部分的装置是(填标号).
②请你帮助他们设计一个实验,证明洗气瓶C中的Na2SO3已被氧化(简述实验步骤): .
③写出D装置中发生反应的离子方程式 .
④该实验存在明显的缺陷,请你提出改进的方法 .
⑤该小组又进行了如下实验:称取漂白粉2.0g,研磨后溶解,配制成250mL溶液,取出25mL加入到锥形瓶中,再加入过量的KI溶液和过量的H2SO4溶液,静置.待完全反应后,用0.1molL﹣1的Na2S2O3溶液作标准液滴定反应生成的碘,已知反应方程式为:2Na2S2O3+I2═Na2S4O6+2NaI,共用去Na2S2O3溶液20.0mL.则该漂白粉中Ca(ClO)2的质量分数为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】浓度为0.50mol/L的某金属阳离子Mn+的溶液10.00mL,恰好与0.4mol/L的NaOH溶液12.50 mL完全反应,生成沉淀,则n等于( )
A. 3B. 2C. 1D. 4
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com