
(10分)固定和利用CO2能有效地利用资源,并减少空气中的温室气体.工业上有一种用CO2来生产甲醇燃料的方法:CO2(g)+3H2(g) CH3OH(g)+H2O(g)+49kJ。某科学实验将6molCO2和8molH2充入2L的密闭容器中,测得H2的物质的量随时间变化如图实线所示。a,b,c,d括号内数据表示坐标.
CH3OH(g)+H2O(g)+49kJ。某科学实验将6molCO2和8molH2充入2L的密闭容器中,测得H2的物质的量随时间变化如图实线所示。a,b,c,d括号内数据表示坐标.
(1)0~a,a~b,b~c,c~d四段中,平均反应速率最大的时间段是___________ ,该时间段内H2的平均反应速率是_____________。
(2)平衡时CO2的转化率是多少?反应前后容器内的压强比时多少?(请按计算题格式在答题卡上作答)
L)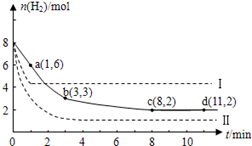
(1)0~a段;该时间段内H2的平均反应速率是1mol/(L·min) (2)33% ;7︰5
解析试题分析:(1)0~a段:V(H2)="(8mol-6mol)÷2L÷1min=1mol/(L·min);" a~b段:V(H2)="(6mol-3mol)÷" 2L÷ 2min="0.75mol/(L·min);" b~c段:V(H2)="(3mol-2mol)÷2L÷5min=0.1mol/(L·min);" c~d段:V(H2)="(2" mol- 2mol)÷2L÷5min0=0.1mol/(L·min)。所以平均反应速率最大的时间段是0~a段。该时间段内H2的平均反应速率是1mol/(L·min)。(2) 在反应过程中H2的物质的量改变6mol,因为CO2与H2反应的物质的量的比为1:3,所以CO2反应消耗的物质的量为2mol.因此平衡时CO2的转化率是(2mol÷6molCO2) ×100%= 33%。反应前后容器内的压强比等于气体的物质的量的比。在反应开始时,n(总)=6+8=14mol;当反应达到平衡时,n(H2)=2mol;n(CO2)=(6-2)mol=4mol;n(CH3OH)=2mol;n(H2O)= 2mol。所以n(总)平衡=10mol.n(开始):n(平衡)=14:10=7︰5。所以反应前后容器内的压强比7︰5。
考点:考查气体的物质的量与压强的关系、化学反应速率的比较与计算及物质的平衡转化率的计算的知识。


科目:高中化学 来源: 题型:填空题
在一定条件下,NO与NO2混合可生成N2O3,反应的化学方程式为:NO(g)+NO2(g) N2O3(g) ΔH<0
N2O3(g) ΔH<0
下图表示一定量的NO、NO2混合气体发生反应时,NO2浓度在前25s内的变化。该反应进行到45s时达到平衡,测得NO2浓度约为0.010mol/L。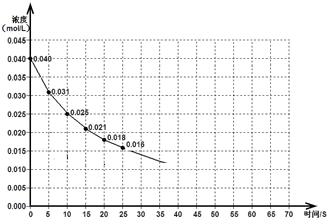
(1)前20s内,NO2的平均反应速率为_________________。
(2)其他条件不变,①升高温度,NO2的转化率_______ (填“增大”、“减小”或“不变”)。
②压缩气体体积,该反应平衡向_______移动(填“正向”或“逆向”)。
(3)若反应延续至70秒,请在答题卡图中画出25秒至70秒的反应进程曲线。
(4)若在反应开始时加入催化剂(其他条件都不变),请在答题卡图中画出加催化剂后的反应进程曲线。
(5)NO、NO2的混合气体用NaOH溶液吸收,得到的盐只有一种,则该反应的离子方程式为:___________________________________,该反应的氧化剂是______________。
查看答案和解析>>
科目:高中化学 来源: 题型:问答题
(18分)碱金属元素的单质及其化合物被广泛应用于生产、生活中。
②一定量的Na在足量O2中充分燃烧,参加反应的O2体积为5.6 L(标准状况),则该反应过程中转移电子的数目为_________。
(2)金属锂广泛应用于化学电源制造,锂水电池就是其中的一种产品。该电池以金属锂和 钢板为电极材料,以LiOH为电解质,加入水即可放电。
总反应为:2Li+2H2O=2LiOH+H2↑
①锂水电池放电时,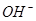 向_________极移动。
向_________极移动。
②写出该电池放电时正极的电极反应式:_________________。
③电解熔融LiCl可以制备金属Li。但LiC1熔点在873 K以上,高温下电解,金属Li产量极低。经过科学家不断研究,发现电解LiCl—KCl的熔盐混合物可以在较低温度下生成金属Li。
你认为,熔盐混合物中KCl的作用是_________________________________________。
写出电解该熔盐混合物过程中阳极的电极反应式:______________________________。
(3)最新研究表明,金属钾可作工业上天然气高温重整的催化剂,有关反应为: 。一定温度下,向2 L容积不变的密闭容器中充入4 mol
。一定温度下,向2 L容积不变的密闭容器中充入4 mol 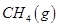 和6 mo1 H2O(g)发生反应,10 min时,反应达到平衡状态,测得CH4(g)和H2(g)的物质的量随时间变化的曲线如图所示。
和6 mo1 H2O(g)发生反应,10 min时,反应达到平衡状态,测得CH4(g)和H2(g)的物质的量随时间变化的曲线如图所示。
①0~10 min内用 (CO)表示的化学反应速率为_________。
(CO)表示的化学反应速率为_________。
②下列叙述中,能够证明该反应已达到平衡状态的是_________(填序号)。
a.生成3 molH-H键的同时有4 molC-H键断裂
b.其他条件不变时,反应体系的压强保持不变
c.反应混合气体的质量保持不变
d.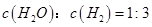
③此温度下,该反应的化学平衡常数K=_________mo12·L-2。
查看答案和解析>>
科目:高中化学 来源: 题型:问答题
[15分]甲烷自热重整是先进的制氢方法,包含甲烷氧化和蒸汽重整。向反应系统同时通入甲烷、氧气和水蒸气,发生的主要化学反应有:
| 反应过程 | 化学方程式 | 焓变△H (kJ/mol) | 活化能Ea (kJ/mol) |
| 甲烷氧化 | CH4(g)+2O2(g) CO2(g)+2H2O(g) CO2(g)+2H2O(g) | -802.6 | 125.6 |
CH4(g)+O2(g) CO2(g)+2H2(g) CO2(g)+2H2(g) | -322.0 | 172.5 | |
| 蒸汽重整 | CH4(g)+H2O(g) CO(g)+3H2(g) CO(g)+3H2(g) | 206.2 | 240.1 |
CH4(g)+2H2O(g) CO2(g)+4H2(g) CO2(g)+4H2(g) | 165.0 | 243.9 |
 CO2(g)+H2(g)的△H= kJ/mol。
CO2(g)+H2(g)的△H= kJ/mol。 CO(g)+3H2(g)的KP= ;
CO(g)+3H2(g)的KP= ;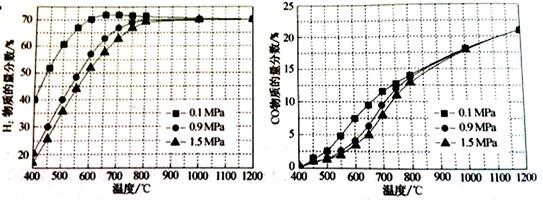
查看答案和解析>>
科目:高中化学 来源: 题型:问答题
(14分)2SO2(g)+O2(g) 2SO3(g)是生产硫酸的主要反应之一。下表是原料气按
2SO3(g)是生产硫酸的主要反应之一。下表是原料气按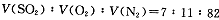 投料,在
投料,在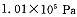 时,不同温度下SO2的平衡转化率。
时,不同温度下SO2的平衡转化率。
(1)该反应是_ 反应(填“放热”或“吸热”)。
(2)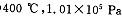 时,将含10 mol SO2的原料气通入一密闭容器中进行反应平衡时SO2的物质的量是 mol。
时,将含10 mol SO2的原料气通入一密闭容器中进行反应平衡时SO2的物质的量是 mol。
(3)硫酸厂尾气(主要成分为SO2、O2和N2)中低浓度SO2的吸收有很多方法。
①用氨水吸收上述尾气,若尾气中SO2与氨水恰好反应得到弱碱性的(NH4)2SO3溶液,则有关该溶液的下列关系正确的是 (填序号)。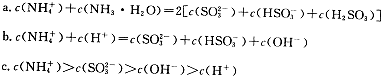
②用MnO2与水的悬浊液吸收上述尾气并生产MnSO4
i.得到MnSO4的化学方程式是
ii.该吸收过程生成MnSO4时,溶液的pH变化趋势如图甲,SO2的吸收率与溶液pH的关系如图乙。
图甲中pH变化是因为吸收中有部分SO2转化为H2SO4生成H2SO4反应的化学方程式是____;由图乙可知pH的降低 SO2的吸收(填“有利于”或“不利于”),用化学平衡移动原理解释其原因是 。
查看答案和解析>>
科目:高中化学 来源: 题型:问答题
I.800℃时,向容积为2L的恒容密闭容器中充入一定量的CO和H2O维持恒温,发生反应CO(g)+H2O(g) H2(g)+CO2(g),反应过???中测定的部分数据见下表:
H2(g)+CO2(g),反应过???中测定的部分数据见下表:
| 反应时间/min | 0 | 2 | 4 | 6 |
| n(CO)/mol | 1.20 | 0.90 | | 0.80 |
| n(H2O)/ mol | 0.60 | | 0.20 | |


 2NH4+(aq) + Mg(OH)2(s)该反应化学平衡常数的表达式为K= ,列出该反应平衡常数K与Kb(NH3·H2O)、Ksp(Mg(OH)2)的关系式 。
2NH4+(aq) + Mg(OH)2(s)该反应化学平衡常数的表达式为K= ,列出该反应平衡常数K与Kb(NH3·H2O)、Ksp(Mg(OH)2)的关系式 。查看答案和解析>>
科目:高中化学 来源: 题型:计算题
加热时,N2O5可按下列分解:N2O5 N2O3 + O2,N2O3又可按下列分解: N2O3
N2O3 + O2,N2O3又可按下列分解: N2O3 N2O + O2。今将 4 molN2O5充入一升密闭容器中,加热至 t℃时反应达到了平衡状态。平衡时,c(O2)=" 4.5" mol/L, c(N2O3)=" 1.62" mol/L,c(N2O)= mol/L,此时N2O5的分解率为 。
N2O + O2。今将 4 molN2O5充入一升密闭容器中,加热至 t℃时反应达到了平衡状态。平衡时,c(O2)=" 4.5" mol/L, c(N2O3)=" 1.62" mol/L,c(N2O)= mol/L,此时N2O5的分解率为 。
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
在2L容器中3种物质间进行反应,X、Y、Z的物质的量随时间的变化曲线如图。反应在t时到达平衡,依图所示:
①该反应的化学方程式是 。
②反应起始至t,Y的平均反应速率是 。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
控制变量法是研究化学变化规律的重要思想方法。请仔细观察下表中50ml稀盐酸和1g碳酸钙反应的实验数据:
| 实验 序号 | 碳酸钙状态 | c(HCl)/mol·L-1 | 溶液温度/oC | 碳酸钙消失时间/s | |
| 反应前 | 反应后 | ||||
| 1 | 粒状 | 0.5 | 20 | 39 | 400 |
| 2 | 粉末 | 0.5 | 20 | 40 | 60 |
| 3 | 粒状 | 0.6 | 20 | 41 | 280 |
| 4 | 粒状 | 0.8 | 20 | 40 | 200 |
| 5 | 粉末 | 0.8 | 20 | 40 | 30 |
| 6 | 粒状 | 1.0 | 20 | 40 | 120 |
| 7 | 粒状 | 1.0 | 30 | 50 | 40 |
| 8 | 粒状 | 1.2 | 20 | 40 | 90 |
| 9 | 粒状 | 1.2 | 25 | 45 | 40 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com