
【题目】A、B、C为中学常见单质,其中一种为金属;通常情况下,A为固体,B、C均为气体。D、E、F、G、H、X均为化合物,其中X是一种无氧强酸、E为黑色固体,H在常温下为液体。它们之间的转化关系如图所示(其中某些反应条件和部分反应物已略去)。
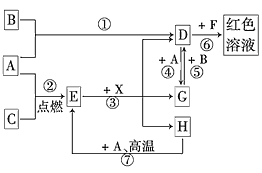
(1)在反应①~⑦中,不属于氧化还原反应的是________(填编号)。
(2)写出③的离子方程式:________________
(3)反应⑦的化学方程式为____;该反应中每消耗0.3 mol的A,可转移电子_________mol。在解决此题时的关键一步是____________。
【答案】①②④⑤⑦ Fe3O4+8H+=2Fe3++Fe2++4H2O 3Fe+4H2O(g) ![]() Fe3O4+4H2 0.8mol ⑥
Fe3O4+4H2 0.8mol ⑥
【解析】
A、B、C为中学常见单质,其中一种为金属,结合后面的红色溶液,中学化学里的红色溶液除了指示剂外,常见的是铁离子遇到SCN-生成的Fe(SCN)3,所以可以确定金属为铁。通常情况下,A为固体,B、C均为气体,所以A为铁,能和铁反应的常见的气体有氧气和氯气,故B和C分别为氧气和氯气中的一种。铁和B生成的D加KSCN显红色,所以B为氯气,D为FeCl3;则C为氧气,E为Fe3O4。X是一种无氧强酸,即为盐酸,Fe3O4和盐酸反应生成FeCl2、FeCl3和水,H在常温下为液体,所以H为水, G为FeCl2。Fe可以和水蒸气在高温下生成Fe3O4和氢气。综上所述,A为Fe,B为Cl2,C为O2,D为FeCl3,E为Fe3O4,F为含SCN-的溶液,G为FeCl2,H为H2O。
(1)反应①是2Fe+3Cl2![]() 2FeCl3;②是3Fe+2O2
2FeCl3;②是3Fe+2O2![]() Fe3O4;③是Fe3O4+8HCl=2FeCl3+FeCl2+4H2O;④是2FeCl3+Fe=3FeCl2; ⑤是2FeCl2+Cl2=2FeCl3;⑥是Fe3++3SCN-=Fe(SCN)3;⑦是3Fe+4H2O(g)
Fe3O4;③是Fe3O4+8HCl=2FeCl3+FeCl2+4H2O;④是2FeCl3+Fe=3FeCl2; ⑤是2FeCl2+Cl2=2FeCl3;⑥是Fe3++3SCN-=Fe(SCN)3;⑦是3Fe+4H2O(g) ![]() Fe3O4+4H2。有化合价变化的反应是氧化还原反应,所以其中①②④⑤⑦氧化还原反应;
Fe3O4+4H2。有化合价变化的反应是氧化还原反应,所以其中①②④⑤⑦氧化还原反应;
(2)③的化学方程式为Fe3O4+8HCl=2FeCl3+FeCl2+4H2O,故离子方程式为Fe3O4+8H+=2Fe3++Fe2++4H2O;
(3)反应⑦的化学方程式为3Fe+4H2O(g) ![]() Fe3O4+4H2。该反应中每消耗3mol铁,转移电子8mol,所以每消耗0.3 mol的铁,可转移电子0.8mol。在解决此题时的关键一步是第⑥步,从红色溶液推断。
Fe3O4+4H2。该反应中每消耗3mol铁,转移电子8mol,所以每消耗0.3 mol的铁,可转移电子0.8mol。在解决此题时的关键一步是第⑥步,从红色溶液推断。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】下列有关实验原理、方法和结论都正确的是( )
A.向FeCl2溶液中滴加氯水,溶液颜色变成棕黄色,可以证明氯水中含有HClO
B.向一定浓度的CuSO4溶液中通入适量H2S气体,出现黑色沉淀,可以证明氢硫酸的酸性比H2SO4强
C.向乙酸乙酯和少量乙酸的混合溶液中加入过量KOH溶液,振荡、静置后分液,可以除去乙酸乙酯中的少量乙酸
D.向苯和少量苯酚的混合溶液中加入适量NaOH溶液,振荡、静置后分液,可以除去苯中的少量苯酚
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】国际计量大会第26届会议新修订了阿伏加徳罗常数(NA=6.02214076×1023mol-1),并于2019年5月20日正式生效。下列说法中正确的是
A.12g金刚石中含有化学键的数目为4NA
B.将7.1g Cl2溶于水制成饱和氯水,溶液中Cl-、ClO-和HC1O的微粒数之和为0.1NA
C.标准状况下,11.2L NO和11.2L O2混合后,气体的分子总数为0.75NA
D.20g的D2O中含有的质子数为10NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用0.10 moI/LNaOH溶液滴定0.10 mol/LHA溶液,滴定曲线如图a所示,混合溶液的pH与离子浓度变化的关系如图b所示。下列叙述错误的是
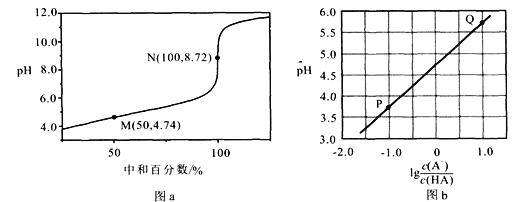
A. Ka(HA)的数量级为10-5
B. N点,![]()
C. P—Q过程中,水的电离程度逐渐增大
D. 当滴定至溶液呈中性时,c(A-)>c(HA)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为研究沉淀的生成及其转化,某小组进行如图实验。关于该实验的分析不正确的是
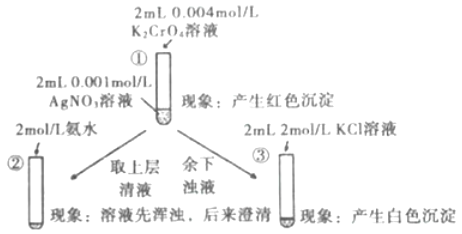
A.①浊液中存在平衡:Ag2CrO4(s)2Ag+(aq)+CrO42-(aq)
B.②中溶液变澄清的原因:AgOH+2NH3·H2O=[Ag(NH3)2]OH+2H2O
C.③中颜色变化说明有AgCl生成
D.该实验可以证明AgCl比Ag2CrO4更难溶
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】物质的量是高中化学常用的物理量,请完成以下有关计算:
(1)相同质量的CO和CO2,它们所含的原子数之比为___________,标准状况下,含有相同氧原子数的CO和CO2的体积之比为_____________。
(2)若a g某气体中含有的分子数为b,则c g该气体在标准状况下的体积是___________(设NA为阿伏加德罗常数的值)。
(3)标准状况下有①0.112 L水 ②0.5NA个HCl分子 ③25.6 g SO2气体 ④0.2 mol氨气(NH3) ⑤2 mol Ne 所含原子个数从大到小的顺序为___________。
(4)V mL Fe2(SO4)3溶液中,含有Fe 3+ m g,取出![]() mL该溶液稀释至4V mL,则溶液中SO42-的物质的量浓度为___________________。(用含有m、V的式子表示)
mL该溶液稀释至4V mL,则溶液中SO42-的物质的量浓度为___________________。(用含有m、V的式子表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种通过铁基氧载体(Fe3O4/FeO)深度还原和再生来合成二甲醚(CH3OCH3) 的原理如图:
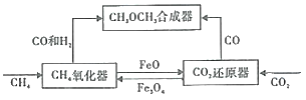
(1)二甲酸的合成反应:3CO(g)+3H2(g)=CH3OCH3(g)+CO2(g);△H1
①已知CO、CH3OCH3与H2的燃烧热(△H)分别为 a kJ/mol、b kJ/mol、c kJ/mol(a、b、c均小于0),则△H1 ____kJ/moL。
②该反应选用(CuO/ZnO/Al2O)复合催化剂,该催化剂能_____(填标号)。
A.提高反应速率 B.促进平衡正向移动 C.改变反应的焓变 D.降低反应的活化能
(2)CH4氧化器中发生的主反应:
i.CH4(g)+Fe3O4(s)=CO(g)+2H2(g)+3FeO(s)
ii.CH4(g)+4Fe3O4(s)=CO2(g)+2H2O(g)+12FeO(s)
850℃时,压强和部分气体体积分数、固相各组分质量分数的关系如图。
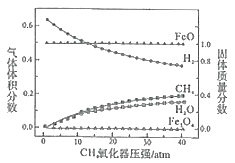
①随着压强的增大,反应i的平衡常数K值________(填“增大”、“减小”或“不变”)。
②结合图像,分析H2O的体积分数变化的原因________(用化学方程式表示)。
(3)将一定量的FeO 和CO2置于CO2还原器(体积不变的密闭容器)中,发生的主反应:CO2(g)+3FeO(s)=Fe3O4(s)+CO(g)。保持其他条件不变,测得不同温度下最终反应体系中CO、CO2体积分数如下表。
温度t/℃ | 100 | 170 | 200 | 300 | 400 | 500 |
CO2体积分数 | 0.67 | 0.67 | 0.75 | 0.82 | 0.9 | 0.92 |
CO体积分数 | 0.33 | 0.33 | 0.25 | 0.18 | 0.1 | 0.08 |
①△H2______0(填“>”或“<”)。
②由上表可知,若在150℃时进行上述转化,理论转化率α(FeO)为100%。在上述反应体系中,一定可以说明该反应达到平衡状态的是______(填标号)。
A.CO2的物质的量不变
B.体系的压强不变
C.气体的平均摩尔质量不变
D.CO的生成速率和消耗速率相等且不等于零
③根据化学反应原理,分析CO2还原器温度设置在170℃的原因________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】抗癌药物“6-Azulenol”的结构简式如图所示,下列有关叙述正确的是( )

A.分子式为C12H18O2
B.分子中含有两种官能团,能发生加成、氧化、酯化反应
C.能使溴水、酸性高锰酸钾溶液褪色,且褪色原理相同
D.lmol该物质与足量的Na反应可产生22.4LH2(标况下)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中可能含有H+,Na+,![]() ,Mg2+,Fe3+,Al3+,
,Mg2+,Fe3+,Al3+,![]() ,
,![]() 等离子.当向该溶液中加入一定物质的量浓度的NaOH溶液时,发现生成沉淀的物质的量随NaOH溶液的体积变化的图像如图所示,下列说法不正确的是( )
等离子.当向该溶液中加入一定物质的量浓度的NaOH溶液时,发现生成沉淀的物质的量随NaOH溶液的体积变化的图像如图所示,下列说法不正确的是( )
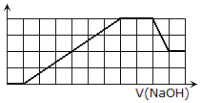
A.原溶液中含有的阳离子是H+,![]() ,Mg2+,Al3+
,Mg2+,Al3+
B.原溶液中一定含有![]() ,一定不含
,一定不含![]()
C.原溶液中含有的Fe3+和Al3+的物质的量之比为1:1
D.反应最后形成的溶液中含有的溶质除了Na2SO4外还有其它物质
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com