
【题目】某溶液中可能含有H+,Na+,![]() ,Mg2+,Fe3+,Al3+,
,Mg2+,Fe3+,Al3+,![]() ,
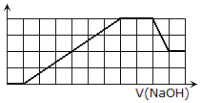
,![]() 等离子.当向该溶液中加入一定物质的量浓度的NaOH溶液时,发现生成沉淀的物质的量随NaOH溶液的体积变化的图像如图所示,下列说法不正确的是( )
等离子.当向该溶液中加入一定物质的量浓度的NaOH溶液时,发现生成沉淀的物质的量随NaOH溶液的体积变化的图像如图所示,下列说法不正确的是( )
A.原溶液中含有的阳离子是H+,![]() ,Mg2+,Al3+
,Mg2+,Al3+
B.原溶液中一定含有![]() ,一定不含
,一定不含![]()
C.原溶液中含有的Fe3+和Al3+的物质的量之比为1:1
D.反应最后形成的溶液中含有的溶质除了Na2SO4外还有其它物质
【答案】A
【解析】
加入NaOH溶液,开始时没有沉淀生成,说明溶液中含有氢离子;根据产生的沉淀量与加入NaOH的物质的量之间的关系图可知,沉淀部分溶解,则溶液中一定含有Al3+,根据离子共存可知,溶液中一定不存在CO32-;
当沉淀达到最大值时,继续进入氢氧化钠,沉淀不变,这说明溶液中还存在NH4+;根据溶液电中性可知,溶液中还必须存在阴离子,所以一定还有SO42-;
从生成沉淀和溶解沉淀耗碱体积比值可知,若为Fe3+,则Fe3+和Al3+的物质的量之比为1:1,刚好与纵坐标数据吻合;若为Mg2+,Mg2+和Al3+的物质的量之比为1.5:1,不能与纵坐标数据吻合,所以溶液中一定含有Fe3+,一定不含Mg2+。
滴加NaOH溶液未生成沉淀前发生反应:H++OH-=H2O,沉淀达到最大值后继续滴加NaOH溶液发生反应:NH4++OH-=NH3H2O,沉淀溶解时发生反应Al(OH)3+OH-=AlO2-+2H2O,故可以肯定溶液中一定有的离子为:H+、NH4+、Al3+;从ab和cd耗碱体积比值可知,若为Fe3+,则Fe3+和Al3+的物质的量之比为1:1,刚好与纵坐标数据吻合;若为Mg2+,Mg2+和Al3+的物质的量之比为1.5:1,不能与纵坐标数据吻合,所以溶液中一定含有Fe3+,一定不含Mg2+;
A.溶液中含有的阳离子必定有Fe3+、H+、NH4+、Al3+,一定不存在Mg2+,故A错误;
B.由分析知:原溶液中一定含有![]() ,一定不含
,一定不含![]() ,故B正确;
,故B正确;
C.根据分析可知,原溶液中含有的Fe3+和Al3+,且二者的物质的量相等,即其物质的量之比为1:1,故C正确;
D.反应最后形成的溶液中含有的溶质除了Na2SO4外,还含有NaAlO2,故D正确;
故答案为A。


 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案科目:高中化学 来源: 题型:
【题目】A、B、C为中学常见单质,其中一种为金属;通常情况下,A为固体,B、C均为气体。D、E、F、G、H、X均为化合物,其中X是一种无氧强酸、E为黑色固体,H在常温下为液体。它们之间的转化关系如图所示(其中某些反应条件和部分反应物已略去)。
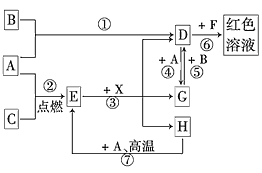
(1)在反应①~⑦中,不属于氧化还原反应的是________(填编号)。
(2)写出③的离子方程式:________________
(3)反应⑦的化学方程式为____;该反应中每消耗0.3 mol的A,可转移电子_________mol。在解决此题时的关键一步是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室需配制500mL 0.2mol/L Na2SO4溶液,实验操作步骤为:
A.把制得的溶液小心地转移至容量瓶中。
B.在天平上称取14.2g 硫酸钠固体,把它放在烧杯中,用适量的蒸馏水将它完全溶解并冷却至室温。
C.继续向容量瓶中加蒸馏水至液面距刻度1~2cm处,改用胶头滴管小心滴加蒸馏水至溶液凹液面底部与刻度线相切。
D.用少量蒸馏水洗涤烧杯和玻璃棒2~3次,每次洗涤的液体都小心注入容量瓶,并轻轻振荡。
E.将容量瓶塞塞紧,充分摇匀。
请填写下列空白:
(1)操作步骤的正确顺序为_______________(填序号)。
(2)本实验用到的基本仪器除烧杯、天平(砝码、镊子)、玻璃棒外,还有__________
(3)下列情况中,会使所配溶液浓度偏低的是________________。
A.某同学观察液面时仰视 B.没有进行上述的操作步骤D
C.加蒸馏水时,不慎超过了刻度线 D.容量瓶使用前内壁沾有水珠
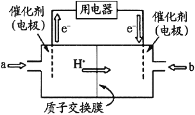
(4)甲醇燃料电池(简称DMFC)由于结构简单、能量转化率高、对环境无污染,可作为常规能源的替代品而越来越受到关注。DMFC工作原理如图所示:通入a气体的电极是原电池的_______极(填 “正”或“负”),其电极反应式为__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以下是以植物细胞中半纤维素木聚糖为原料合成镇痛药品莫沙朵林(G)的路线:
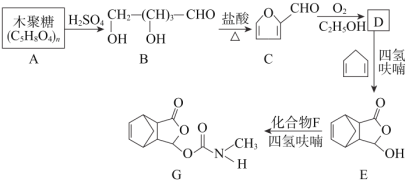
已知:①四氢呋喃(![]() )在流程中作反应的催化剂;
)在流程中作反应的催化剂;
②
③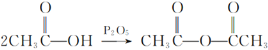
回答下列问题:
(1)B中官能团的名称为______;
(2)E→G的反应类型:______;
(3)D和F的结构简式分别是______、______;
(4)C与新制氢氧化铜反应的化学方程式为:______;
(5)写出同时满足下列条件的E的一种同分异构体的结构简式:______。
①分子中含有苯环②能发生银镜反应③能与FeCl3溶液发生显色反应
(6)有机物H(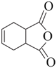 )是合成抗病毒药物阿昔洛韦的中间体。按上述合成路线,写出以1,3-丁二烯为原料制备
)是合成抗病毒药物阿昔洛韦的中间体。按上述合成路线,写出以1,3-丁二烯为原料制备![]() 的合成路线流程图______(无机试剂任选);
的合成路线流程图______(无机试剂任选);
![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列叙述正确的是
A. 常温常压下,8g甲烷中含C-H键数目为0.4NA
B. 标准状况下,11.2LSO3中含分子数目为0.5NA
C. 1L0.1mol/LNH4NO3溶液中含氧原子数目为0.3NA
D. 7.8gNa2O2与足量CO2完全反应转移电子数目为0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】DCCNa (二氯异氰尿酸钠)固体是一种高效、安全的消毒剂。20℃以上易溶于水。(CNO)3H3 (氰尿酸)为三元弱酸。
I.制备DCCA (二氯异氰尿酸)装置如图。主要反应有:
碱溶 (CNO)3H3+ 2NaOH=(CNO)3Na2H + 2H2O △H<0
氯化 (CNO)3Na2H +2Cl2=(CNO)3Cl2H + 2NaCl H<0
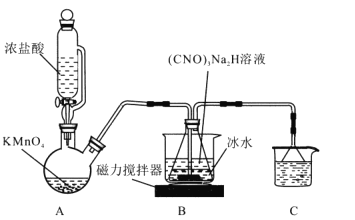
回答下列问题:
(1)装置C中的溶液是______________,作用为______________。
(2)装置A中反应的离子方程式为_______________。
(3)装置B用冰水浴的原因是__________, 碱溶时若氢氧化钠过量,(CNO)3Na2H中可能混有的杂质是__________。
Ⅱ.制备DCCNa
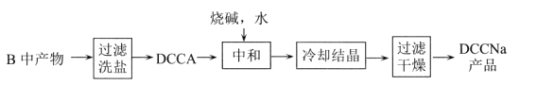
(4)步骤II中过滤洗盐”洗去的盐是__________________。
(5)“中和”反应的化学方程式为_________________。
(6)氧元素含量的测定:称取0. 1000 g DCNa样品,加入一定量醋酸溶液溶解,样品中的氯元素全邵转化成HClO,再加入足量的KI溶液,用淀粉作指示剂, 用01000 mol·L-1Na2S2O3标准溶液滴定生成的碘,消耗VmL.已知: I2+2S2O32-=2I-+S4O62-,样品中氯元素的质量分数=__________%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Na5PW11O39Cu/T1O2膜可催化污染物的光降解,一种生产工艺流程如下,回答下列问题:

(1)“溶解I”发生的离子反应方程式为______________,Na2WO4 (钨酸钠)在酸性条件下有较强的氧化性,该步骤不能用浓盐酸代替浓硝酸的原因是____________。
(2)“除杂”时用过量有机溶剂萃取溶液中的NO3-,再通过_________方法分离杂质。
(3)“溶解II”需要加入水、乙醇和稀硫酸。
①加入乙醇的目的是_____________。
②钛酸四丁酯水解产生TiO2和C4H9OH的化学方程式为_____。
③溶液中Cu2+浓度为0.02 mol·L-1,需调节pH小于________。(已知Ksp[Cu(OH)2]=2×10-20)
(4)培烧温度、Na5PW11O39Cu 用量对Na5PW11O39Cu/TiO2膜催化活性的影响随(时间)变化如图1、图2所示:
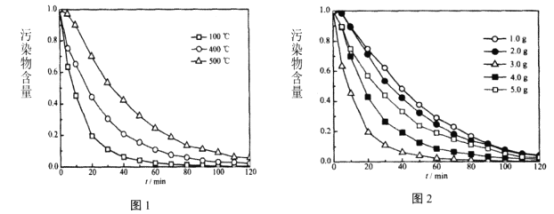
制备Na5PWl1O39Cu/TiO2膜的最佳条件为:培烧温度_____,Na5PW11O39Cu用量_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在没有氧气存在时,铁与水几乎不反应,但高温下,铁能与水蒸气反应。请设计实验,证明还原铁粉与水蒸气能够发生反应。
(1)铁粉与水蒸气反应的化学方程式是: __________________________________________
(2)证明还原铁粉与水蒸气发生了反应的方法是_________________________________________
(3)某同学用如图所示装置进行实验,请帮助该同学完成设计,用下列简图画出未完成的实验装置示意图(铁架台可省略,导气管的形状可根据需要选择)
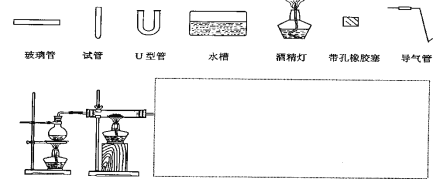 __________
__________
(4)停止反应,待装置冷却后,取出反应过的还原铁粉混合物,加入过量的稀硫酸充分反应,过滤。若混和物中既有Fe3+又有Fe2+,则证明该结论的实验方法:_________________________________________
(5)经检验上述滤液中不含Fe3+,这不能说明还原铁粉与水蒸气反应所得产物中不含+3价的Fe元素。原因是(结合离子方程式说明)___________________________________________
(6)某同学利用上述滤液制取白色的Fe(OH)2沉淀,向滤液中加入NaOH溶液后,观察至生成的白色沉淀迅速变成灰绿色,最后变成红褐色。沉淀由白色→红褐色的化学方程式是:_________________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com