
【题目】为了除去KCl溶液中少量的MgCl2、MgSO4,从稀盐酸、Na2CO3、Ba(NO3)2、K2CO3、Ba(OH)2溶液中,选择A、B、C 3种试剂,按图中的实验步骤进行操作:
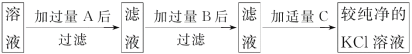
(1)3种试剂的化学式:A______,B______,C______。
(2)加过量A的原因是___________________________________________________________,有关反应的化学方程式为________________________________________________________________。
(3)加过量B的原因是______________________________________________________,有关反应的化学方程式为_____________________________________________________________。
【答案】Ba(OH)2 K2CO3 稀盐酸为了除尽Mg2+、SO![]() MgCl2+Ba(OH)2===BaCl2+Mg(OH)2↓,MgSO4+Ba(OH)2===BaSO4↓+Mg(OH)2↓为了除尽过量的Ba2+Ba(OH)2+K2CO3===2KOH+BaCO3↓,BaCl2+K2CO3===BaCO3↓+2KCl
MgCl2+Ba(OH)2===BaCl2+Mg(OH)2↓,MgSO4+Ba(OH)2===BaSO4↓+Mg(OH)2↓为了除尽过量的Ba2+Ba(OH)2+K2CO3===2KOH+BaCO3↓,BaCl2+K2CO3===BaCO3↓+2KCl
【解析】
试题除去KCl溶液中少量的MgCl2、MgSO4,为防止引入杂质,Na2CO3和Ba(NO3)2是不能使用的。应先加入稍过量的Ba(OH)2,把MgCl2和MgSO4完全沉淀,然后再加入稍过量的K2CO3除去过量的Ba(OH)2,过滤后,向滤液中加入稀盐酸除去过量的K2CO3。
(1)3种试剂的化学式:A、Ba(OH)2,B、K2CO3,C、稀盐酸。
(2)加过量Ba(OH)2的原因是为了除尽Mg2+、SO42-,有关反应的化学方程式MgCl2+Ba(OH)2===BaCl2+Mg(OH)2↓、MgSO4+Ba(OH)2===BaSO4↓+Mg(OH)2↓。
(3)加过量K2CO3的原因是为了除尽过量的Ba2+,有关反应的化学方程式为Ba(OH)2+K2CO3=2KOH+BaCO3↓、BaCl2+K2CO3===BaCO3↓+2KCl


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】氮氧化物会形成光化学烟雾和酸雨,可采取下列方法对氰氧化物进行处理。
(1) SNCR脱硝技术的原理:
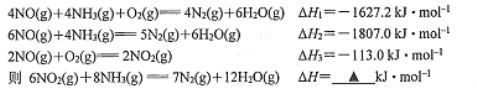 ____________
____________
(2) NSR (NOx储存还原)工作原理:
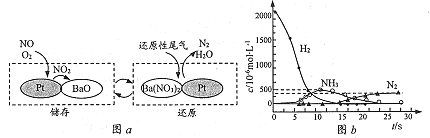
NOx的储存和还原在不同时段交替进行,如图a所示。
①NOx储存转化为Ba(NO3)2过程中,参加反应的NO和02的物质的量之比为_________________。
②H2还原Ba(NO3)2的过程分两步进行,图b表示该过程相关物质浓度随时间的变化关系。第一步反应的化学方程式为__________________。
(3)SCR消除氮氧化物的反应原理:![]()
其他条件相同,某密闭容器中分别投入NH3、NO、O2,在甲、乙两种催化剂作用下,NO转化率与温度的关系如图c所示。在催化剂甲作用下,图中Y点处(对应温度为210℃)NO的转化率一定不是该温度下的平衡转化率的原因是__________________。工业实际选择催化剂乙的原因是___________________。
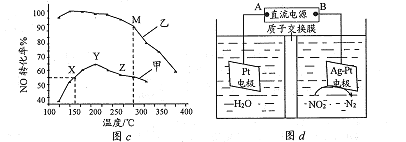
(4)①用石灰乳吸收氨的氧化物,原理为:
![]()
为使吸收充分![]() ___(选填“≥”或“≤”)l。
___(选填“≥”或“≤”)l。
②目前可采用电解的方法除去废水中的NO2-,原理如图d所示。写出阴极的电极反应式:__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】40℃时,在氨-水体系中不断通入CO2,各种离子的变化趋势如下图所示,不正确的是( )
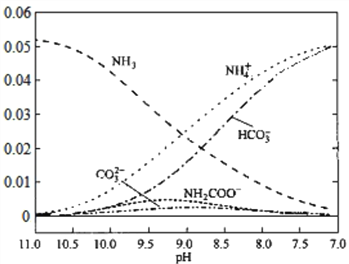
A. 在pH=9.0时,c(NH4+)>c(HCO3ˉ)>c(NH2COOˉ)>c(CO32-)
B. 在氨-水体系中不断通入CO2,体系中始终存在关系:c(NH4+)+c(H+)=2c(CO32-)+c(HCO3ˉ)+c(OHˉ)
C. 随着CO2的通入,![]() 不断减小
不断减小
D. pH=7时,水的电离程度最大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室需要配置100 mL 1.0×10-2 mol·L-1的CuSO4溶液,下列玻璃仪器中,一定要用到的有( )
A. 漏斗 B. 玻璃棒 C. 烧杯 D. 容量瓶
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在1.0 L恒容密闭容器中放入0.10 mol X,在一定温度下发生反应:X(g)![]() Y(g)+Z(g) ΔH<0,容器内气体总压强p随反应时间t的变化关系如图所示。以下分析正确的是( )
Y(g)+Z(g) ΔH<0,容器内气体总压强p随反应时间t的变化关系如图所示。以下分析正确的是( )
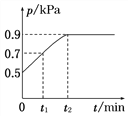
A. 该温度下此反应的平衡常数K=3.2
B. 从反应开始到t1时的平均反应速率v(X)=![]() mol·L-1·min-1
mol·L-1·min-1
C. 欲提高平衡体系中Y的百分含量,可加入一定量的X
D. 其他条件不变,再充入0.1 mol气体X,平衡正向移动,X的转化率减少
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学是一门以实验为基础的学科,下列操作或发生事故时的处理方法正确的是
A. 可用燃着的酒精灯引燃另一只酒精灯。
B. 给试管里的液体加热时,试管应与桌面垂直。
C. 配置一定浓度的NaCl溶液时,定容振荡摇匀后,发现液面低于刻度线,再加水到刻度线。
D. 浓硫酸不慎沾在皮肤上,应立即用大量水冲洗,最后涂上3%-5%的小苏打溶液。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值,下列叙述正确的是( )
A. 1 mol氩气在标准状况下的体积约为11.2 L
B. 20 ℃、10 MPa状态下,32 g O2和O3的混合气体所含原子数为2.5NA
C. 标准状况下,11.2 L H2CO3含有的原子数为3NA
D. 常温常压下,44 g CO2含有的原子数为3NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“化学是你,化学是我”.化学与生产、生活密切相关,下列说法错误的是( )
A. 中国古代利用明矾溶液的酸性清除铜镜表面的铜锈
B. 水泥冶金厂常用高压电除去工厂烟尘,利用了胶体的性质
C. 开发利用太阳能、风能、生物能、海洋能等清洁能源,符合“低碳经济”
D. 二氧化硫有漂白性,常用于棉、麻、纸张和食品的漂白
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜元素位于元素周期表中第ⅠB族,在化合物中其化合价可以呈现+1、+2价。铜的单质及其化合物在很多领域有重要的应用。
Ⅰ.CuSO4和Cu(NO3)2是常见的+2价铜的化合物,有较为广泛的应用。
(1)向CuSO4溶液中滴加氨水,最后可以得到深蓝色的[Cu(NH3)4]SO4溶液。
N、O、S三种元素的第一电离能由大到小的顺序为______________________________。
(2)制备Cu(NO3)2的一种方法是在N2O4的乙酸乙酯溶液中加入铜,反应一段时间后,加热即可得到Cu(NO3)2。NO3-的立体构型的名称为_______________,N原子的杂化方式为________________。NO3-的一种等电子体为________________________。
Ⅱ.CuCl是较为常见的十1价铜的化合物。
(3)基态Cu+的价层电子排布式为________________________。
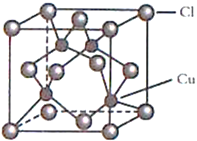
(4)CuCl的晶胞结构如图所示,C1原子位于立方体的顶点和面心, Cu原子位于Cl原子构成的四面体体心。每个Cl原子周围距Cl原子最近且等距离的Cu原子数目为________________。
 。
。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com