
【题目】亚硝酰氯(NOCl)是有机合成中的重要试剂,可由NO和Cl2反应得到,化学方程式为2NO(g)+Cl2(g) ![]() 2NOCl(g)。
2NOCl(g)。
(1)氮氧化物与悬浮在大气中的海盐粒子相互作用时会生成亚硝酰氯,涉及如下反应:
①2NO2(g)+NaCl(s) ![]() NaNO3(s)+NOCl(g)
NaNO3(s)+NOCl(g)
②4NO2(g)+2NaCl(s) ![]() 2NaNO3(s)+2NO(g)+Cl2(g)
2NaNO3(s)+2NO(g)+Cl2(g)
③2NO(g)+Cl2(g) ![]() 2NOCl(g)
2NOCl(g)
设反应①②③对应的平衡常数依次为K1、K2、K3,则K1、K2、K3之间的关系为____________。
(2)300 ℃时,2NOCl(g) ![]() 2NO(g)+Cl2(g)。正反应速率的表达式为v正=k·cn(NOCl)(k为速率常数,只与温度有关),测得速率与浓度的关系如表所示:
2NO(g)+Cl2(g)。正反应速率的表达式为v正=k·cn(NOCl)(k为速率常数,只与温度有关),测得速率与浓度的关系如表所示:
序号 | c(NOCl)/mol·L-1 | v/mol·L-1·s-1 |
① | 0.30 | 3.60×10-9 |
② | 0.60 | 1.44×10-8 |
③ | 0.90 | 3.24×10-8 |
n=________,k=________。
(3)在1 L恒容密闭容器中充入2 mol NO(g)和1 mol Cl2(g),在不同温度下测得c(NOCl)与时间t的关系如图A所示:反应开始到10 min时Cl2的平均反应速率v(Cl2)=________ mol·L-1·min-1。

(4)在密闭容器中充入NO(g)和Cl2(g),改变外界条件[温度、压强、![]() 、与催化剂的接触面积],NO的转化率变化关系如图B所示。X代表________。
、与催化剂的接触面积],NO的转化率变化关系如图B所示。X代表________。
【答案】 K2·K3=K 2 4.0×10-8 L· mol-1·s-1 0.05 压强或![]()
【解析】本题主要考查化学平衡的影响因素及反应速率的计算。
(1)2①=②+③对应的平衡常数依次为K1、K2、K3,则K1、K2、K3之间的关系为K2·K3=K。
(2) 速率与浓度的平方成正比,所以n=2,代入一组数值得k=4.0×10-8 L· mol-1·s-1。
(3)v(Cl2)=1/2/10 mol·L-1·min-1=0.05 mol·L-1·min-1。
(4)NO的转化率随着X增大而增大。该反应放热,温度升高平衡左移,NO的转化率减小。该反应气体物质的量减小,增大压强平衡右移,NO的转化率增大。![]() 增大,NO的转化率增大。与催化剂的接触面积增大,反应速率增大,NO的转化率不变。因此,X代表压强或
增大,NO的转化率增大。与催化剂的接触面积增大,反应速率增大,NO的转化率不变。因此,X代表压强或![]() 。
。


科目:高中化学 来源: 题型:
【题目】和硅同一主族的锗也是重要的半导体材料,锗应用于航空航天测控、光纤通讯等领域。一种提纯二氧化锗粗品(主要含GeO2、As2O3)的工艺如下:

已知:①“碱浸”过程中的反应为:GeO2+2NaOH=Na2GeO3+H2O、As2O3+2NaOH=2NaAsO2+H2O
② GeCl4的熔点为-49.5℃,AsCl3与GeCl4的沸点分别为130.2℃、84℃。
(1)砷的原子序数为33,砷在元素周期表中的位置为第______周期第________族。
(2)“氧化除砷”的过程是将NaAsO2氧化为Na3AsO4,其反应的离子方程式为:___________________________________________________________________。
(3)传统的提纯方法是将粗品直接加入盐酸中蒸馏,其缺点是_________________。
(4)“蒸馏”过程中的反应的化学方程式为:________________________________。
(5)“水解”操作时保持较低温度有利于提高产率,其最可能的原因是_____________(答一条即可)。
(6)若1吨二氧化锗粗品(含杂质30%)经提纯得0.745吨的较纯二氧化锗产品,则杂质脱除率为_________。
(7)和砷同一主族的锑也可以用于半导体中。一种突破传统电池设计理念的镁—锑液态金属二次电池工作原理如图所示:

该电池由于密度的不同,在重力作用下分为三层,工作时中间层熔融盐的组成不变。充电时,C1-向______(填“上”或“下”)移动;放电时,正极的电极反应式为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醛(HCHO)在化工、医药、农药等方面有广泛的应用。利用甲醛一定条件下直接脱氢可制甲醛,反应方程式:CH3OH(g)![]() HCHO(g)+H2(g) △H1
HCHO(g)+H2(g) △H1
实验测得随温度升高,平衡常数如下表所示。
温度(K) | 500 | 700 | T1 | T2 | T3 |
平衡常数 | 7.13×10-4 | 3.30×10-1 | 2.00 | 9.00 | 10.00 |
(1)甲醛分子中所有原了都达到稳定结构,甲醛的电子式为_____________。
(2) 若在恒温恒压容器中进行上述反应,可判断反应到达平衡状态的是_______________。
A.混合气体的密度不变
B.CH3OH、HCHO的物质的量浓度之比为1:1
C.H2的体积分数不再改变
D.单位时间内甲醛的生成量与氢气的消耗量相等
(3)T1时,CH3OH、HCHO、H2 起始浓度(mol·L-1)分别为1.0、0.50 、1.0,反应达到平衡时,HCHO 的体积分数___________20% (填“>”、“ =”、“ <”)。
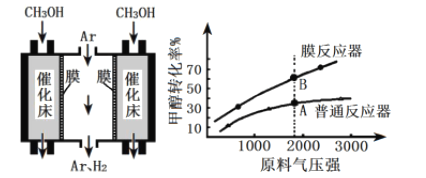
(4)工业上采用膜分离器(对氢气具有很高的选择性和透过率)催化脱氢,装置如下图。为探究转化率变化,分别在普通反应器和膜反应器中,改变原料气压强,控制相同温度,经过相同反应时间,测定甲醇转化率,实验结果如下图。
①A点:v正______v逆(填“>”、“ =”、“ <”),理由是____________;
②B点比A点转化率高的原因是_______________。
(5)体系中加入一定量氧气有利于甲醛的生成。反应体系中存在下列反应:
CH3OH(g)+1/2O2(g)![]() HCHO(g)+H2O(g) △H2
HCHO(g)+H2O(g) △H2
H2(g)+12O2(g)![]() H2O(g) △H3
H2O(g) △H3
则△H2、△H3的大小关系是△H2________△H3(填“>”、“ =”、“ <”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:①![]() ②
②![]() ③
③![]() 的分子式均为C8H8,下列说法正确的是
的分子式均为C8H8,下列说法正确的是
A. ①②③的三氯代物与五氯代物的同分异构体数目相同
B. ①②③均能使酸性高锰酸钾溶液因发生化学反应而褪色
C. ②分子中所有原子一定在同一平面内
D. 仅从碳的四价考虑,①的同分异构体只有②和③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】原子序数依次增大的元素X、Y、Z、W,它们的最外层电子数分别为1、4、6、1。X的一种核素中无中子,Y和Z的次外层有8个电子,Z2-和W+具有相同的电子层结构。下列叙述正确的是
A. 离子半径:W+>Z2- B. Y的单质在信息技术中应用广泛
C. X和W不可能形成离子化合物 D. W的氢氧化物的碱性比氢氧化镁弱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中,若忽略水的电离,只含有下表中所示的四种离子,试推测X离子及其个数b可能为( )
离子 | Na+ | Al3+ | Cl﹣ | X |
个数 | 2a | a | a | b |
A.NO3﹣、2a
B.SO42﹣、2a
C.OH﹣、2a
D.SO42﹣、4a
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在0.1 mol·L-1 CH3COOH溶液中存在如下电离平衡:CH3COOH![]() CH3COO-+H+,对于该平衡,下列叙述正确的是( )
CH3COO-+H+,对于该平衡,下列叙述正确的是( )
A. 加入少量0.1 mol·L-1 HCl溶液,溶液中c(H+)不变
B. 加入水稀释时,平衡向正反应方向移动,溶液中所有离子的浓度都减小
C. 加入少量CH3COONa固体,平衡向逆反应方向移动,平衡常数变大
D. 加入少量NaOH固体,促进了醋酸的电离,溶液中![]() 变大
变大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1﹣丁醇和乙酸在浓硫酸作用下,通过酯化反应制得乙酸正丁酯(沸点126℃),反应温度为115﹣125℃,反应装置如图。下列对该实验的描述中错误的是

A. 提纯乙酸正丁酯需要经过水、氢氧化钠溶液洗涤
B. 长玻璃管起冷凝回流作用
C. 不能用水浴加热
D. 利用浓硫酸的吸水性,可以提高乙酸正丁酯的产率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某原电池总反应的离子方程式为:2Fe3++Fe![]() 3Fe2+,能实现该反应的原电池是
3Fe2+,能实现该反应的原电池是
A. 正极为Cu,负极为Fe,电解质为FeCl3溶液
B. 正极为C,负极为Fe,电解质为FeSO4溶液
C. 正极为Fe,负极为Zn,电解质为Fe2(SO4)3溶液
D. 正极为Ag,负极为Cu,电解质为CuSO4溶液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com