
| A. | Q1+Q2>Q3 | B. | Q1+Q2>2Q3 | C. | Q1+Q2<Q3 | D. | Q1+Q2=Q3 |
分析 根据反应热△H=反应物的总键能-生成物的总键来计算该反应的反应热,氢气在氯气中燃烧,反应热△H<0,据此解答.
解答 解:破坏2mol氢气中的化学键消耗的能量为Q2kJ,破坏2mol氯气中的化学键消耗的能量为Q1kJ,形成4mol氯化氢的化学键释放的能量为Q3kJ,对于2H2(g)+2Cl2(g)═4HCl(g) 反应热△H=反应物的总键能-生成物的总键能=Q1kJ/mol+Q2kJ/mol-Q3kJ/mol=(Q1+Q2-Q3)kJ/mol.由于氢气在氯气中燃烧,反应热△H<0,即(Q1+Q2-Q3)<0,所以Q1+Q2<Q3.
故选C.
点评 本题考查反应热的计算,题目难度不大,注意把握从键能的角度计算反应热的方法.


科目:高中化学 来源: 题型:填空题
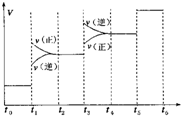 氢气是一种新型的绿色能源,又是一种重要的化工原料.
氢气是一种新型的绿色能源,又是一种重要的化工原料.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na+、Mg2+、Cl-、OH- | B. | H+、Ca2+、CO32-、NO3- | ||
| C. | Cu2+、K+、SO42-、NO3- | D. | Na+、HCO3-、K+、H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
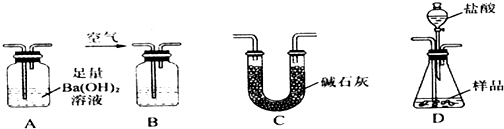
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 实验 | 酸或碱 | 现象 |
| A | 1滴0.2mol/LNaOH溶液 | 不变色 |
| B | 1滴水 | 缓慢变浅棕褐色 |
| C | 1滴0.1mol/L硫酸溶液 | 迅速变棕褐色 |

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 2SO2(g)+O2(g)?2SO3(g);△H<0 | B. | 4NH3(g)+O2(g)?4NO(g)+6H2O (g);△H<0 | ||
| C. | H2(g)+I2(g)?2HI (g);△H>0 | D. | C (s)+H2O (g)?CO (g)+H2 (g);△H>0 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com