

| A. | 2SO2(g)+O2(g)?2SO3(g);△H<0 | B. | 4NH3(g)+O2(g)?4NO(g)+6H2O (g);△H<0 | ||
| C. | H2(g)+I2(g)?2HI (g);△H>0 | D. | C (s)+H2O (g)?CO (g)+H2 (g);△H>0 |
科目:高中化学 来源: 题型:解答题
| 阳离子 | K+、Al3+、Ba2+、NH4+ |
| 阴离子 | Cl-、OH-、SO42-、CO32- |
 . Al3+、K+、SO42-三种离子可组成一种盐,写出该盐的一种用途净水剂.
. Al3+、K+、SO42-三种离子可组成一种盐,写出该盐的一种用途净水剂. NH3•H2O+H+.
NH3•H2O+H+.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Q1+Q2>Q3 | B. | Q1+Q2>2Q3 | C. | Q1+Q2<Q3 | D. | Q1+Q2=Q3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢氧化铁溶胶、水玻璃、淀粉溶液、PM2.5微粒均具有丁达尔效应 | |
| B. | 明矾和漂白粉常用于自来水的处理,两者的作用原理相同 | |
| C. | 氯化铁溶液可用于制作印刷电路板是因为其具有较强氧化性,与铜发生置换反应 | |
| D. | 高温能杀死流感病毒是因为构成病毒的蛋白质受热变性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 14C原子的结构示意图: | |
| B. | H2O2的电子式: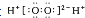 | |
| C. | NH4C的电子式: | |
| D. | 原子核内有10个中子的氧原子${\;}_{8}^{16}$O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com